Состав, строение и функции белка в клетке, биологическое значение
Содержание:
- Отличие белков растительного и животного происхождения
- Полноценные и неполноценные белки
- Свойства белков
- Строение белков
- Как белок влияет на организм
- Аминокислоты – это кислоты, не так ли? Что насчет кислотности?
- Биологическое значение белков
- Радиационная биохимия
- Сколько человеку нужно белка потреблять в день
- Какую роль играет белок для организма человека
- Структурная функция
- Составляющие белков
- Какие функции в организме выполняют белки
Отличие белков растительного и животного происхождения
Животные белки – те, что содержатся в продуктах, которые мы получаем благодаря домашнему скоту и рыбной ловле (различные виды мяса и птицы, рыба и морепродукты, яйца, молочная и кисломолочная продукция). Они считаются полноценными источниками белка в еде, так как содержат все незаменимые аминокислоты, необходимые организму для эффективного функционирования:
- Витамин B12. Принимает участие в синтезе ДНК и формировании нервных волокон.
- Витамин D. Содержится в жирной рыбе, яйцах и молочных продуктах и лучше усваивается в данном виде, хотя его содержат и некоторые растения. Участвует в обмене веществ и способствует лучшему усвоению кальция.
- Докозагексаеновая кислота (ДГК) – это важный компонент омега-3, содержащийся в жирной рыбе. Он полезен для работы мозга и его трудно получить из растительных источников.
- Гемовое железо. Содержится в мясе (преимущественно красном), печени и рыбе. Оно помогает в процессе обмена кислородом, влияет на общее самочувствие и работу мозга.
- Цинк. Содержится в источниках животного белка, таких как говядина, свинина и баранина. От него зависит состояние кожи, волос, ногтей и каким будет процесс обновления клеток.
Учтите, что не все мясо полезно. Например, красное необработанное мясо говядины, свинины, баранины, телятины, следует употреблять в ограниченном количестве.
Также избегайте обработанного мяса (бекон, сосиски, колбасы, мясное ассорти).
Продукты, содержащие белки растительного и животного происхождения
В отличие от белков животного происхождения, растительные содержатся в бобах, орехах, крупах, овощах, соевых продуктах и пр. Они считаются неполноценными, поскольку в них отсутствует одна или несколько незаменимых аминокислот, которые нужны организму. Чаще всего им не хватает метионина, триптофана, лизина и изолейцина. Именно поэтому диетологи и врачи настаивают на сбалансированном питании, чтобы получать полный комплекс питательных веществ.
Могут ли веганы и вегетарианцы получать необходимое количество белка только из продуктов растительного происхождения? Да. Кроме того, исследования показывают, что благодаря этому вегетарианцы зачастую имеют меньшую массу тела, более низкий уровень холестерина и артериального давления.
Полноценные и неполноценные белки
Белки, поступающие в организм с пищей, разделяются на биологически полноценные и биологически неполноценные.
Биологически полноценными называются те белки, в которых в достаточном количестве содержатся все аминокислоты, необходимые для синтеза белка животного организма. В состав полноценных белков, необходимых для роста организма, входят следующие незаменимые аминокислоты: лизин, триптофан, треонин, лейцин, изолейцин, гистидин, аргинин, валин, метионин, фенилаланин. Из этих аминокислот могут образоваться другие аминокислоты, гормоны и т. д. Из фенилаланина образуется тирозин, из тирозина путем превращений — гормоны тироксин и адреналин, из гистидина — гистамин. Метионин участвует в образовании гормонов щитовидной железы и необходим для образования холина, цистеина и глютатиона. Он необходим для окислительно-восстановительных процессов, азотистого обмена, усвоения жиров, нормальной деятельности головного мозга. Лизин участвует в кроветворении, способствует росту организма. Триптофан также необходим для роста, участвует в образовании серотонина, витамина РР, в тканевом синтезе. Лизин, цистин и валин возбуждают сердечную деятельность. Малое содержание цистина в пище задерживает рост волос, увеличивает содержание сахара в крови.
Биологические неполноценными называются те белки, в которых отсутствуют хотя бы даже одна аминокислота, которая не может быть синтезирована животными организмами.
Биологическая ценность белка измеряется количеством белка организма, которое образуется из 100 г белка пищи.
Белки животного происхождения, содержаться в мясе, яйцах и молоке, наиболее полоненные (70-95%). Белки растительного происхождения имеют меньшую биологическую ценность, например белки ржаного хлеба, кукурузы (60%), картофеля, дрожжей (67%).
Белок животного происхождения – желатина, в котором нет триптофана и тирозина, является неполноценным. В пшенице и ячмене мало лизина, в кукурузе мало лизина и триптофана.
Некоторые аминокислоты заменяют друг друга, например фенилаланин заменяет тирозин.
Два неполноценных белка, в которых недостает разлчных аминокислот, вместе могут составить полноценное белковое питание.
Свойства белков
Примем во внимание два главных свойства:
- Денатурация — нарушение природной структуры белка при воздействии на него определенных факторов (высокой температуры, излучения, воздействия кислот, щелочей, солей). Обратимая денатурация называется ренатурацией — процесс обратим, если не разрушается первичная структура, являющаяся основной. При необратимой денатурации затрагивается первичная структура, которая восстановиться уже не может. В качестве примера такого процесса можно привести яйцо, которое на сковороде превращается в яичницу. В этом случае строение белка полностью нарушено и не восстановимо.
- Белки — органические растворители. Данные макромолекулы используются и как отличные растворители.
Обязательно стоит перейти к вопросу о классификациях белков. Разные биополимеры имеют разное строение, а также физические свойства.
Рис. 5. Четвертичная структура белка
Строение белков
В пространственном строении белков большое значение имеет характер радикалов (остатков) R— в молекулах аминокислот. Неполярные радикалы аминокислот обычно располагаются внутри макромолекулы белка и обусловливают гидрофобные взаимодействия; полярные радикалы, содержащие ионогенные (образующие ионы) группы, обычно находятся на поверхности макромолекулы белка и характеризуют электростатические (ионные) взаимодействия. Полярные неионогенные радикалы (например, содержащие спиртовые ОН-группы, амидные группы) могут располагаться как на поверхности, так и внутри белковой молекулы. Они участвуют в образовании водородных связей.
В молекулах белка α-аминокислоты связаны между собой пептидными (—СО—NH—) связями:
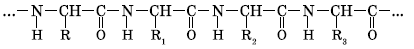
Построенные таким образом полипептидные цепи или отдельные участки внутри полипептидной цепи могут быть в некоторых случаях дополнительно связаны между собой дисульфидными (—S—S—) связями или, как их часто называют, дисульфидными мостиками.
Большую роль в создании структуры белков играют ионные (солевые) и водородные связи, а также гидрофобное взаимодействие — особый вид контактов между гидрофобными компонентами молекул белков в водной среде. Все эти связи имеют различную прочность и обеспечивают образование сложной, большой молекулы белка.
Несмотря на различие в строении и функциях белковых веществ, их элементный состав колеблется незначительно (в % на сухую массу): углерода — 51-53; кислорода — 21,5-23,5; азота — 16,8-18,4; водорода — 6,5-7,3; серы — 0,3-2,5.
Некоторые белки содержат в небольших количествах фосфор, селен и другие элементы.
Последовательность соединения аминокислотных остатков в полипептидной цепи получила название первичной структуры белка.
Белковая молекула может состоять из одной или из нескольких полипептидных цепей, каждая из которых содержит различное число аминокислотных остатков. Учитывая число их возможных комбинаций, можно сказать, что разнообразие белков почти безгранично, но не все из них существуют в природе.
Общее число различных типов белков у всех видов живых организмов составляет 1011-1012. Для белков, строение которых отличается исключительной сложностью, кроме первичной, различают и более высокие уровни структурной организации: вторичную, третичную, а иногда и четвертичную структуры.
Вторичной структурой обладает большая часть белков, правда, не всегда на всем протяжении полипептидной цепи. Полипептидные цепочки с определенной вторичной структурой могут быть по-разному расположены в пространстве.
В формировании третичной структуры, кроме водородных связей, большую роль играют ионное и гидрофобное взаимодействия. По характеру «упаковки» белковой молекулы различают глобулярные, или шаровидные, и фибриллярные, или нитевидные, белки (табл. 12).
Для глобулярных белков более характерна а-спиральная структура, спирали изогнуты, «свернуты». Макромолекула имеет сферическую форму. Они растворяются в воде и солевых растворах с образованием коллоидных систем. Большинство белков животных, растений и микроорганизмов относится к глобулярным белкам.
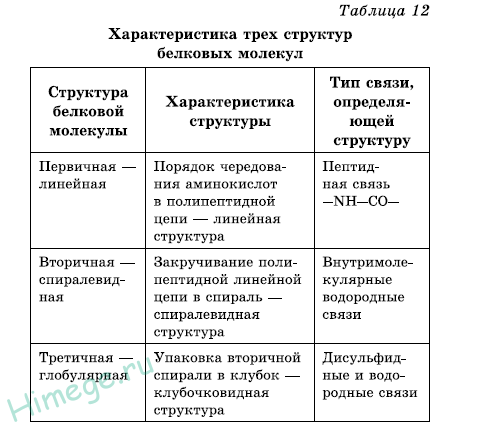
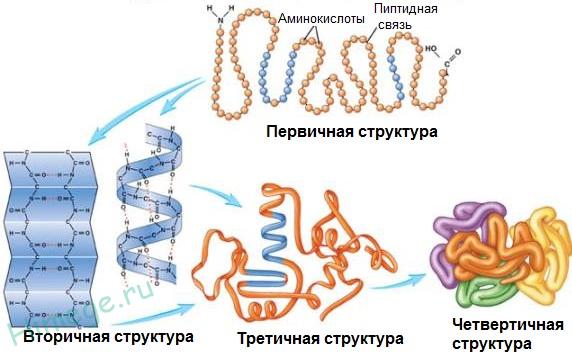
Для фибриллярных белков более характерна нитевидная структура. Они, как правило, не растворяются в воде. Фибриллярные белки обычно выполняют структурообразующие функции. Их свойства (прочность, способность растягиваться) зависят от способа упаковки полипептидных цепочек. Примером фибриллярных белков служат миозин, кератин. В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют сложные ансамбли. В этом случае образуется четвертичная структура белков.
Примером белка с четвертичной структурой служит гемоглобин крови. Только с такой структурой он выполняет свои функции — связывание кислорода и транспортировка его в ткани и органы.
Однако следует отметить, что в организации более высоких структур белка исключительная роль принадлежит первичной структуре.
Как белок влияет на организм
Тело человека примерно на 20% состоит из белков. Когда мы едим, протеины из продуктов расщепляются на аминокислоты, из которых организм синтезирует собственные белки, необходимые ему для жизнедеятельности . Научные исследования подтверждают: если начать есть больше белковой пищи, можно уменьшить потребление калорий, ускорить обмен веществ и вырастить мышцы.
Дает ощущение сытости
Белок помогает уменьшить аппетит и насытиться меньшим количеством пищи, а значит — снизить калорийность рациона . Это объясняется несколькими факторами. Во-первых, его переваривание — сложный и длительный процесс. Во-вторых, протеин уменьшает уровень «гормона голода» грелина и повышает уровень пептида YY, который дает чувство сытости , . Кроме того, канадские ученые выяснили, что белковая пища снижает концентрацию сахара в крови .
Улучшает метаболизм
Для переваривания пищи нашему организму нужны дополнительные калории. Около 10% от суточной потребности. Это называется термогенным эффектом. Им обладают все продукты, но на усвоение белка расходуется намного больше калорий, чем на усвоение углеводов и жиров . Исследование американских ученых показало: при употреблении белковой пищи в день сжигается в среднем на 260 калорий больше . Примерно столько уходит за часовое занятие йогой.
Помогает нормализовать вес
Белковая пища помогает стать стройнее. Исследователи из Университета Вашингтона в Сиэтле предложили девушкам с избыточным весом повысить дозу белка в рационе до 30%. Через три месяца они проверили результат. Оказалось, что участницы эксперимента потеряли в среднем по 5 кг . При этом никто из них не следил за потреблением калорий. Кроме того, продукты, богатые белком, позволяют дольше удерживать вес после возвращения к привычному режиму питанию .
На усвоение белка расходуется больше колорий, чем на усвоение углеводов и жиров
Ускоряет рост мышц
Увеличение количества белка в рационе в сочетании с силовыми упражнениями помогает сделать мышцы сильнее и больше . А если вы не тренируетесь — защитить их от разрушения. Дефицит калорий во время диет может привести к неприятным последствиям. Одно из них — потеря мышечной массы. Это можно предотвратить, если начать есть протеин чаще . Кроме того, употребление большего количества белка уменьшает риск возрастной атрофии мышц , .
Укрепляет кости
Существует распространенное мнение, что протеин животного происхождения вымывает из костей кальций. Это миф. Напротив, он способствует удержанию кальция в костях и делает их плотнее . При этом нет никаких убедительных доказательств того, что растительный белок безопаснее, чем животный . Скорее наоборот: ученые доказали, что диета с повышенным содержанием мясного белка уменьшает риск остеопороза и переломов у пожилых людей .
Способствует заживлению ран
Другое важное свойство белка — он ускоряет процесс регенерации тканей . Если мы не получаем достаточное количество протеина с пищей, в организме замедляется выработка коллагена
Именно он отвечает за самовосстановление тканей при различных повреждениях кожи — будь то царапины, ссадины, ожоги или раны , . Кроме того, он помогает восстановлению после операций и способствует заживлению пролежней. При недостатке протеина раны заживают намного дольше .
Аминокислоты – это кислоты, не так ли? Что насчет кислотности?
Теоретически можно доказать вред аминокислот за счет их избыточной кислотности. Но клинической проблемой это не является: их кислотность слишком мала, чтобы причинить какие-либо неприятности.
Минеральная плотность костной ткани (МПКТ)
Анализ крупного обзорного исследования не дает никакой связи между потреблением белка и риском переломов костей (показатель их здоровья). Исключением является ситуация, когда на фоне повышенной дозы белка в рационе общее потребление кальция падает ниже уровня 400 мг/1000 ккал ежедневно (хотя отношение рисков было довольно слабым и составило 1,51 при сравнении с самой высокой квартилью) (26). В других исследованиях сходной корреляции выявить не удалось, хотя логически этого следовало бы ожидать (27,28).
В ходе одного интервенционного исследования было показано, что потребление белка на самом деле положительно влияет на минеральную плотность костной ткани. Но данная взаимосвязь была выявлена лишь в случаях, когда контролировалось влияние сульфатов, полученных при окислении серосодержащих аминокислот (29).
Соевый белок, похоже, сам по себе обладает дополнительным защитным эффектом для костной ткани у женщин в постменопаузе, что может быть связано с содержанием в сое изофлавонов (30). Для получения дополнительной информации, пожалуйста, прочитайте наш список часто задаваемых вопросов об изофлавонах сои.
Роль почек
Почки могут резко увеличивать скорость клубочковой фильтрации, или скорость фильтрации крови. Они делают это в ответ на потребление белка (31). При некоторых заболеваниях данный компенсационный механизм не срабатывает, поэтому в таких случаях контроль за потреблением белка является частью терапии (32).
Кроме того, почки участвуют в регулировании кислотно-щелочного баланса в организме при помощи бикарбонатной буферной системы (33). Нарушение кислотно-щелочного баланса может привести к появлению патологических симптомов и развитию почечных осложнений.
Данными защитными способностями, по всей видимости, обладают здоровые почки, но при заболеваниях они начинают давать сбои.
Роль силовых тренировок
В одном из исследований крысы подвергались резкому воздействию значительных доз белка в рационе, в результате чего у них наблюдалось ухудшение работы почек. Но «тренировки с отягощениями» уменьшали у некоторых из них негативный эффект и оказывали защитные действие (8).
Биологическое значение белков
Белки-это высокомолекулярные (молекулярная масса варьируется от 5-10 тыс. до 1 млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (греч. «протос» — первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей присущей ему последовательностью расположения аминокислотных остатков.
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
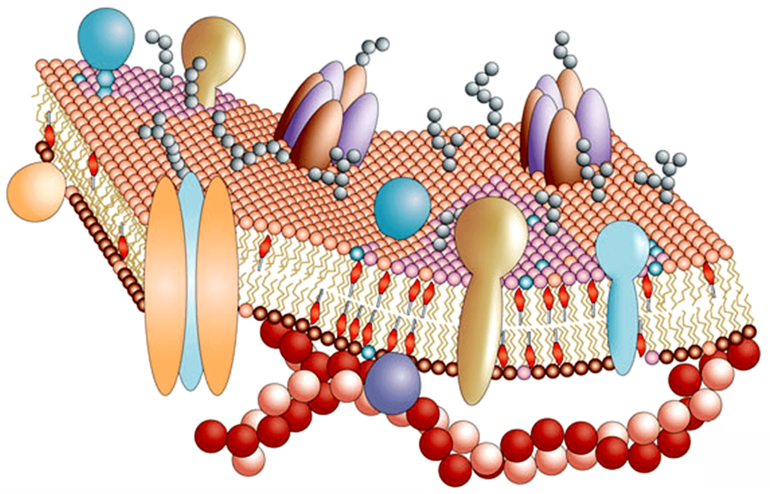
Белки — основа биомембран, важнейшей составной части клетки и клеточных компонентов. Они играют ключевую роль в жизни клетки, составляя как бы материальную основу ее химической деятельности.
Исключительное свойство белка — самоорганизация структуры, т. е. его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки — важнейшая составная часть пищи человека и животных, поставщик необходимых аминокислот.
Радиационная биохимия
Радиационная Б. изучает изменения обмена веществ, возникающие в организме при действии на него ионизирующей радиации. Облучение вызывает ионизацию и возбуждение молекул клетки, реакции их с возникающими в водной среде свободными радикалами (см.) и перекисями, что приводит к нарушению структур биосубстратов клеточных органелл, равновесия и взаимных связей внутриклеточных биохимических процессов. В частности, эти сдвиги в сочетании с пострадиационными воздействиями со стороны поврежденной ц. н. с. и гуморальных факторов дают начало вторичным нарушениям обмена веществ, обусловливающим течение лучевого заболевания. Важную роль в развитии лучевой болезни играет ускорение распада нуклеопротеидов, ДНК и простых белков, торможение их биосинтеза, нарушения скоординированного действия ферментов, а также окислительного фосфорилирования (см.) в митохондриях, уменьшение количества АТФ в тканях и усиленная окисляемость липидов с образованием перекисей (см. Лучевая болезнь, Радиобиология, Радиология медицинская).
Библиография: Афонский С. И. Биохимия животных, М., 1970; Биохимия, под ред. H. Н. Яковлева, М., 1969; ЗбарекиЙ Б. И., Иванов И. И. и М а р-д а ш e в С. Р. Биологическая химия, JI., 1972; Кретович В. JI. Основы биохимии растений, М., 1971; JI e н и н д-ж e р А. Биохимия, пер. с англ., М., 1974; Макеев И. А., Гулевич В. С. иБроуде JI. М. Курс биологической химии, JI., 1947; Малер Г. Р. и КордесЮ. Г. Оснопы биологической химии, пер. с англ., М., 1970; Фердман Д. JI. Биохимия, М., 1966; Филиппович Ю. Б. Основы биохимии, М., 1969; III т р а у б Ф. Б. Биохимия, пер. с венгер., Будапешт, 1965; R а р о р о г t S. М. Medizinische Bioc-hemie, B., 1962.
Периодические издания — Биохимия, М., с 1936; Вопросы медицинской химии, М., с 1955; Журнал эволюционной биохимии и физиологии, М., с 1965; Известия АН СССР, Серия биологические науки, М., с 1958; Молекулярная биология, М., с 1967; Украшський бюхем1чний журнал, Кшв, с 1946 (1926—1937 — Науков1 записки Украшського бюхемичного шети-туту, 1938—1941 — Бюхем1чний журнал); Успехи биологической химии, JI., с 1924; Успехи современной биологии, М., с 1932; Annual Review of Biochemistry, Stanford, с 1932; Archives of Biochemistry and Biophysics, N. Y., с 1951 (1942—1950 — Archives of Biochemistry); Biochemical Journal, L., с 1906; Biochemische Zeitsch-rift, В., с 1906; Biochemistry, Washington, с 1964; Biochimica et biophysica acta, N. Y.— Amsterdam, с 1947; Bulletin de la Soci6t<5 de chimie biologique, P., с 1914; Comparative Biochemistry and Physiology, L., с 1960; Hoppe-Seyler’s Zeitschrift fiir physiologische Chemie, В., с 1877; Journal of Biochemistry, Tokyo, с 1922; Journal of Biological Chemistry, Baltimore, с 1905; Journal of Molecular Biology, L.—N.Y., с 1960; Journal of Neurochemistry, L., с 1956; Proceedings of the Society for Experimental Biology and Medicine, N. Y., с 1903; См. также в ст. Клиническая биохимия, Физиология, Химия.
Б. радиационная — Кузин А. М. Радиационная биохимия, М., 1962; P о -манцев Е. Ф. и д р. Ранние радиационно-биохимические реакции, М., 1966; Федорова Т. А., Терещенко О. Я. и М а з у р и к В. К. Нуклеиновые кислоты и белки в организме при лучевом поражении, М., 1972; Черкасова Л. С. и д р. Ионизирующее излучение и обмен веществ, Минск, 1962, библиогр.; Altman К. I., Gerber G. В. а. О k a d a S. Radiation biochemistry, v. 1—2, N. Y.— L., 1970.
Сколько человеку нужно белка потреблять в день
Белок — совершенно незаменимая часть питания. Как бы вы ни перестраивали свой рацион, никогда значительно не уменьшайте количество белка: он необходим вашему организму. Далее разберем, сколько человеку нужно белка для полноценного удовлетворения суточных потребностей.
При каждом приеме пищи старайтесь сочетать менее ценные растительные белки (хлеб, каши, : макароны) с белками животного происхождения (молоко, творог, сыр, мясо, рыба, яйца).
Сколько белка надо в день, можно рассчитать по установленным санитарным нормам. Согласно современным российским нормам для не занятых физическим трудом и спортом здоровых мужчин и женщин в возрасте 18-29 лет потребность в белке составляет в среднем 1 граммов на 1 килограммов нормальной для данного человека массы тела. При этом доля животных белков должна составлять не менее 55 % от общего количества белка. Некоторые считают эти рекомендации завышенными. Но не вызывает сомнения тот факт, что в рационе людей, перенесших обширные хирургические вмешательства или серьезные травмы, при ожоговой болезни, переломах костей, заболеваниях органов пищеварения (таких, как хронические энтериты и панкреатиты, состояния после резекции тонкой кишки и желудка и др.), нагноительных заболеваниях легких, активном туберкулезе, злокачественных опухолях, кровопотерях, приеме кортикостероидных и анаболических гормонов и т. д., а также для пациентов, выздоравливающих после тяжелых инфекций, потребление животного белка может быть увеличено до 55-60 %. Однако даже в этих случаях количество белка, поступающего в организм, как правило, не должно превышать 120-130 граммов в сутки. Сколько белков надо потреблять — зависит от образа жизни, физических нагрузок, состояния здоровья и многих других факторов.
Какую роль играет белок для организма человека
Ученые выяснили, что при отсутствии белка, стала бы невозможной как таковая жизнь на Земле.
Мы уже говорили, что белок:
- является основным материалом, который выполняет строительную функцию для всего организма;
- служит основой для появления новых клеток и тканей;
- участвует в формировании и поддержании в норме различных органов;
- стимулирует появление ферментов и большей части гормонов;
- поддерживает уровень гемоглобина в крови и других важный веществ.
Также он может выполнять защитную функцию, нейтрализуя различные виды инфекций. Он способствует улучшенному усвоению витаминов и минеральных веществ.
Так как в процессе жизни, организм расходует большое количества белка, то его нужно постепенно восполнять. Все дело в том, что этот биологический элемент не накапливается и не создается организмом в отличие от других веществ.
Структурная функция
Кроме белков, которые выполняют высокоспециализированные функции, имеются и такие, значение которых в основном структурно. Благодаря им обеспечивается механическая прочность, а также другие свойства тканей живых организмов. К таким белкам относится, прежде всего, коллаген. Коллаген (на фото см. ниже) у млекопитающих составляет около четверти массы белков. Он синтезируется в основных клетках, из которых состоит соединительная ткань (они называются фибробластами).
Первоначально коллаген образуется в качестве проколлагена — его предшественника, проходящего химическую обработку в фибробластах. Затем он формируется в виде трех полипептидных цепей, скрученных в спираль. Они объединяются уже вне фибробластов в коллагеновые фибриллы в несколько сотен нанометров диаметром. Последние же образуют коллагеновые нити, которые уже можно увидеть под микроскопом. В эластичных тканях (стенках легких, кровеносных сосудов, в коже) внеклеточный матрикс, помимо коллагена, содержит также белок эластин. Он может растягиваться в довольно широких пределах и возвращаться затем в исходное состояние. Другой пример структурного белка, который можно здесь привести, — это фиброин шелка. Его выделяют во время формирования куколки гусеницы шелкопряда. Это главный компонент шелковых нитей. Переходим к описанию двигательных белков.
Составляющие белков
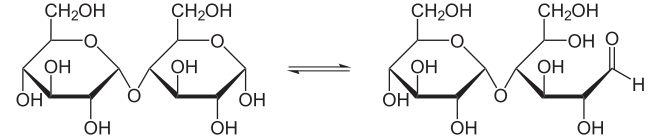
Аминокислоты растворимы в воде, находятся в порошкообразном состоянии, имеют в своем строении аминогруппу, карбоксильную группу и радикал. Радикал может быть представлен ароматическим кольцом, цепочкой. В его состав могут входить соединения, содержащие серу. Мономеры белков могут быть кислыми или основными, в зависимости от количества групп NH2и COOH.Вступая в реакции друг с другом, аминокислоты образуют дипептиды, трипептиды и полипептиды.Перед тем, как перейти к детальному рассмотрению строения молекул белков, изучим все связи, существующие в белках разных типов:
- Пептидные — основные связи в белках, ковалентные, прочные;
- Ионные — образуются посредством анионов COO- и катионов NH3+;
- Водородные — слабые, но когда их возникает много, то цепочки становятся прочнее;
- Связи вида S-S — образуются посредством дисульфидных мостиков.
Эти связи являются основными в белковых молекулах.
Рис. 2. Альфа-спираль
Какие функции в организме выполняют белки
Все процессы, которые происходят в нашем организме – обмен веществ, развитие, движение, старение – это все превращение существования функции белков.
Каждая аминокислота играет собственную роль как для синтезе белка, так и для других процессов, определяющих здоровье человека, его уровень энергии, умственные способности и пр. Белок для организма — это комплекс аминокислот, соединенных между собой пептидами.
функции белков в организме
Белки для организма играют важную роль. Они участвуют в защите человека от инфекций, а также способствуют усвоению витаминов и минеральных веществ. При отсутствии суточной нормы белка строительство новых мышечных волокон невозможно, а регенерация существующих будет замедлятся. Поэтому получать с пищей суточную норму белка обязательно для здоровья и хорошего внешнего вида.
Коллаген это белок, все разновидности эластина, мышечные клетки, гормоны, ферменты, иммуноглобулины и т.д. это все белки. Самым ценным с биохимической точки зрения является обмен белков.
Все остальное – витамины, минералы, микроэлементы нужно для обслуживания белков. Без белка ничего этого не нужно, оно не будет иметь никакого смысла.
Какие основные функции в организме выполняют белки
Строительная
В организме идет постоянный процесс обновления клеток – одни клетки отмирают, а на их месте образуются другие, материалом для их построения служит белок.
Рецепторная
Без протеина неосуществима работа органов чувств, позволяющих нам воспринимать окружающий мир: ощущать запахи, видеть, слышать и т.д.
Иммунная
Протеин содействует выведению вредных веществ из организма, подавляет возбудителей инфекций и способствует повышению сопротивляемости организма в целом.
Гормональная
Без деятельности гормонов невыполнима исправная работа органов и систем всего организма, а их большая часть состоит именно из белка
Поддержание хорошего гормонального фона очень важно для женского здоровья
Транспортная
Гемоглобин, который также является белком, содействует транспортировке кислорода из легких в ткани нашего организма, а также выводит углекислый газ.
Двигательная
Без протеина невозможна корректная работа опорно-двигательного аппарата, так как кости, связки, суставы, мышцы состоят из белков.
При дефиците аминокислот в организме человека могут возникать следующие неприятные симптомы:
- умственная и физическая утомляемость;
- слабость в мышцах;
- боль в суставах;
- отеки;
- «необъяснимые» приступы голода;
- уменьшение остроты зрения;
- ухудшение качества волос, ногтей, кожи.