Белки
Содержание:
Основные свойства белков
Структура и свойства белков могут изменяться под влиянием разных физико-химических факторов: действие концентрированных кислот и щелочей, тяжелых металлов, изменение температуры и т. п. Одни из белков легко изменяют структуру под незначительным действием разнообразных факторов, другие – стойкие к подобным влияниям. Основные свойства белка это – денатурация, ренатурация, деструкция.
Денатурация
Денатурация – это процесс нарушения естественной структуры белка с сохранением пептидных связей (первичной структуры). Может быть необратимым процессом. Но при условии прекращения действия отрицательных факторов на первых стадиях белок может восстанавливать свое нормальное состояние, то есть происходит обратная денатурация – ренатурация.
Ренатурация
Ренатурация – это способность белка восстанавливать нормальную структуру после устранения действия отрицательных факторов. Выполнение некоторых функций – двигательной, сигнальной, каталитической и т. п. – у живых организмов связано с частичной обратной денатурацией белков.
Медицинские офисы KDLmed
- КЛИНИКА 1
- КЛИНИКА 2
- КЛИНИКА 3
АДРЕС:г. Пятигорск, проспект 40 лет Октября, 62/3
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
Взятие крови: пн-сб 7:30 — 12:00
вс 8:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30 / вс 8:30 — 12:00
ТЕЛЕФОН:(8793) 330-640
+7 (928) 225-26-74
АДРЕС:г. Пятигорск, проспект 40 лет Октября, 14
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
Взятие крови: пн-сб 7:30 — 12:00
вс 8:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30 / вс 8:30 — 12:00
ТЕЛЕФОН:(8793) 327-327
+7 (938) 302-23-86
АДРЕС:г. Пятигорск, ул. Адмиральского, 6А
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00
Взятие крови: пн-сб 7:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30
ТЕЛЕФОН:(8793) 98-13-00
+7 (928) 363-81-28
АДРЕС:г. Ставрополь, ул. Ленина, 301
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
ТЕЛЕФОН:(8652) 35-00-01
+7 (938) 316-82-52
- КЛИНИКА 1
- КЛИНИКА 2
АДРЕС:г. Невинномысск, ул. Гагарина, 19
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 15:00
вс 8:30 — 14:00
ТЕЛЕФОН:(86554) 7-08-18
+7 (928) 303-82-18
АДРЕС:г.Невинномысск, ул. Гагарина, 60
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 13:00
ТЕЛЕФОН:8 (86554) 6-08-81
8 (938) 347-42-17
АДРЕС:г. Нефтекумск, 1-й микрорайон, ул. Дзержинского, 7
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86558) 4-43-83
+7 (928) 825-13-43
АДРЕС:г. Буденновск, пр. Энтузиастов, 11-Б
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86559) 5-55-95
+7 (938) 302-23-89
АДРЕС:г. Зеленокумск, ул. Гоголя, д.83
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86552) 6-62-14
+7 (938) 302-23-90
АДРЕС:г. Минеральные Воды, ул. Горская, 61, 13/14
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 16:00 / вс 8:30 — 15:00
ТЕЛЕФОН:(87922) 6-59-29
+7 (938) 302-23-88
- КЛИНИКА 1
- КЛИНИКА 2
АДРЕС:г. Ессентуки, ул. Володарского, 32
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:30 / вс 8:30 — 13:00
ТЕЛЕФОН:(87934) 6-62-22
+7 (938) 316-82-51
АДРЕС:г.Ессентуки, ул.Октябрьская 459 а
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 14:30
ТЕЛЕФОН:(87934) 99-2-10
+7 (938) 300-75-28
АДРЕС:г. Георгиевск, ул. Ленина, 123/1
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
ТЕЛЕФОН:(87951) 50-9-50
+7 (938) 302-23-87
АДРЕС:г. Благодарный, ул. Первомайская, 38
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86549) 24-0-24
+7 (928) 363-81-37
АДРЕС:г. Светлоград, ул. Пушкина, 19 (Центр, Собор)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86547) 40-1-40
+7 (928) 363-81-41
АДРЕС:с. Донское, ул. 19 Съезда ВЛКСМ, 4 А
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86546) 34-330
+7 (928) 363-81-25
АДРЕС:г. Новоалександровск, ул. Гагарина, 271 (пересечение с ул. Пушкина)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8(86544) 5-46-44
+7 (928) 363-81-45
АДРЕС:с. Александровское, ул. Гагарина, 24
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86557) 2-13-00
+7 (928) 363-81-35
АДРЕС:с. Кочубеевское, ул. Братская, 98 (ТЦ «ЦУМ»)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 13:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86550) 500-22
+7 (928) 363-81-42
АДРЕС:г. Железноводск, ул. Ленина, 127
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 17.30
сб 7:30 — 13:00
ТЕЛЕФОН:(87932) 32-8-26
+7 (928) 363-81-30
АДРЕС:с. Арзгир, ул. Кирова, 21 (Рынок)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 14:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86560) 31-0-41
+7 (928) 363-81-44
АДРЕС:г.Ипатово, ул. Ленинградская, 54
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8 (86542) 5-85-15
8 (938) 347-42-16
АДРЕС:ст. Ессентукская, ул. Павлова, 17
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:30
ТЕЛЕФОН:8 (87961) 6-61-00
8 (938) 347-42-18
АДРЕС:ст. Курская, ул. Калинина, д. 188
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8(87964) 5-40-10
8(938) 347-43-29
- Пятигорск
- Ставрополь
- Невинномысск
- Нефтекумск
- Буденновск
- Зеленокумск
- Минеральные Воды
- Ессентуки
- Георгиевск
- Благодарный
- Светлоград
- Донское
- Новоалександровск
- Александровское
- Кочубеевское
- Железноводск
- Арзгир
- Ипатово
- Ессентукская
- Курская
Гены у человека
Обратите внимание, что не все эти гены активны.
- Класс I: MYO1A , MYO1B , MYO1C , MYO1D , MYO1E , MYO1F , MYO1G , MYO1H
- Класс II: MYH1 , MYH2 , MYH3 , MYH4 , MYH6 , MYH7 , MYH7B , MYH8 , MYH9 , MYH10 , MYH11 , MYH13 , MYH14 , MYH15 , MYH16
- Класс III: MYO3A , MYO3B
- Класс V: MYO5A , MYO5B , MYO5C
- Класс VI: MYO6
- Класс VII: MYO7A , MYO7B
- Класс IX: MYO9A , MYO9B
- Класс X: MYO10
- Класс XV: MYO15A
- Класс XVIII: MYO18A , MYO18B
Легкие цепи миозина различны и обладают собственными свойствами. Они не считаются «миозинами», но являются компонентами макромолекулярных комплексов, из которых состоят функциональные ферменты миозина.
Легкая цепь: MYL1 , MYL2 , MYL3 , MYL4 , MYL5 , MYL6 , MYL6B , MYL7 , MYL9 , MYLIP , MYLK , MYLK2 , MYLL1
Состав
cMyBP-C представляет собой белок 140,5 кДа, состоящий из 1273 аминокислот. cMyBP-C — это миозин-ассоциированный белок, который связывается с интервалами 43 нм вдоль основной цепи толстой миозиновой нити, растягиваясь на 200 нм по обе стороны от M-линии в зоне, несущей поперечный мостик (C-область) полосы A в поперечно-полосатые мышцы. Приблизительная стехиометрия cMyBP-C вдоль толстой нити составляет 1 на 9-10 молекул миозина, или 37 молекул cMyBP-C на толстую нить. Помимо миозина, cMyBP-C также связывает тайтин и актин . Изоформа cMyBP-C, экспрессируемая в сердечной мышце, отличается от изоформы, экспрессируемой в медленных и быстрых скелетных мышцах ( MYBPC1 и MYBPC2 соответственно), тремя особенностями: (1) дополнительным иммуноглобулиновым (Ig) -подобным доменом на N-конце, (2 ) линкерная область между вторым и третьим доменами Ig и (3) дополнительная петля в шестом домене Ig . cMyBP-C, по-видимому, необходим для нормального порядка, длины волокон и расстояния между решетками в структуре саркомера .
Функции белков в клетке:
- Строительная – обусловлена наличием белка во всех клеточных структурах. (Форма всех органелл клетки зависит от структуры белков).
- Каталитическая – реакции в клетке без ферментов идут медленно, так как концентрации исходных веществ (субстратов) в клетке малы. Обычно размеры молекул ферментов больше, чем размеры субстратов. Например, молекулярная масса каталазы, разрушающей пероксид водорода Н2О2, равна 250000, а самого пероксида – 34. Активный центр фермента – лишь небольшой участок его молекулы, на котором и происходит сама реакция. Фермент сравнивают с замком, а субстрат – с ключом, так как они должны точно подходить друг другу. Каждая реакция катализируется своим ферментом, однако существуют ферменты, которые катализируют несколько реакций.
- Двигательная – все движения обусловлены работой двигательных (сократительных) белков. В мышечных клетках при сокращении нитей более активна внедрённая между волокнами миозина за счёт энергии АТФ.
- Транспортная – белок гемоглобин транспортирует кислород и углекислый газ в организме. Через мембраны происходит транспорт различных веществ (сахар, ионы и др.).
- Защитная – осуществляется с помощью антител и антигенов. Антитела – белковые структуры β-лимфоцитов избирательно связывающиеся с чужеродными белками и клетками. Антигены – белки на поверхности клетки или в растворе, по которым Т-лимфоциты различают свои клетки и чужеродные. Убитые или ослабленные бактерии и вирусы (вакцины) несут свои антигены. При введении их в организм иммунная система вырабатывает антитела, что препятствует заболеванию.
- Энергетическая – белки являются источниками энергии. 1г белка при окислении даёт 17,6 кДж. Белок при разрушении образует СО2, Н2О, NH3. Аммиак NH3 ядовит, поэтому в печени он превращается в мочевину и мочевую кислоту.
- Регуляторная – пептидные гормоны, выделяемые железами внутренней секреции, изменяют обмен веществ в клетках определенных тканей.
Инсулин активирует захват молекулы глюкозы клеткой и синтез из неё гликогена. Без инсулина клетки голодают, так как не поглощают глюкозу, в результате чего развивается сахарный диабет. Т-лимфоциты передают с помощью белков информацию о чужеродных клетках β-лимфоцитам.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Свойства белков так же разнообразны, как и функции. Одни растворяются в воде и образуют коллоидные растворы, другие растворяются в разбавленных растворах солей. Некоторые нерастворимы, например, белки кожи.
ХИМИЧЕСКИЕ СВОЙСТВА
В радикалах АК-остатков белков содержатся различные функциональные группы, способные вступать в химические реакции:
- восстановления;
- этерификации;
- лкилирования;
- нитрования.
Будучи амфотерным соединением белок реагирует и с кислотами, и со щелочами.
Парамиозин
Парамиозин — это большой мышечный белок , 93–115 кДа , который был описан в ряде различных типов беспозвоночных . Считается, что толстые нити беспозвоночных состоят из внутреннего парамиозинового ядра, окруженного миозином. Миозин взаимодействует с актином , что приводит к сокращению волокон. Парамиозин обнаружен у многих различных видов беспозвоночных, например у Brachiopoda , Sipunculidea , Nematoda , Annelida , Mollusca , Arachnida и Insecta . Парамиозин отвечает за механизм «захвата», который обеспечивает устойчивое сокращение мышц с очень небольшими затратами энергии, так что моллюск может оставаться закрытым в течение длительного времени.
Миозин в мышечных волокнах
Основу толстого филамента саркомера (миофибриллы) составляет белок миозин. Впервые белок миозин был выделен из скелетных мышц в начале XX века.
Характеристика молекулы миозина
Молекула белка миозина (миозина II типа), который участвует в сокращении саркомера, имеет молекулярную массу 500 кДа. Длина молекулы равна 150 нм, а толщина – 2 нм. Молекула миозина образована четырьмя полипептидными цепями, две из которых (тяжелые) имеют молекулярную массу по 200 кДа, а две – легкие 20 и 17 кДа.
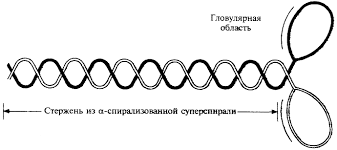
Рис. 1. Состав и структура молекулы миозина
Состав и структура молекулы миозина
Молекула миозина состоит из «хвоста» или «стержня» и двух «головок» (рис.1). Хвост миозина состоит из двух цепей, каждая из которых свернута в α-спираль. Две α-спирали дополнительно скручены в суперспираль. Эта суперспираль является стержнем (хвостом) миозиновой молекулы. Ее длина равна 135 нм.
На верхнем конце стержня две нити расходятся, сплетаются с дополнительными двумя легкими цепями и формируют две миозиновые головки. За счет головок длина миозиновой молекулы достигает 150 нм , а толщина – 2 нм. По этим характеристикам молекула миозина превосходит все молекулярные структуры, имеющиеся в природе.
Соединение между головкой и стержнем молекулы миозина подобно шарниру. Это позволяет головкам наклоняться и прикрепляться к молекулам актина.
Более подробно строение и функции мышц описаны в моих книгах
«Гипертрофия скелетных мышц человека» и Биомеханика опорно-двигательного аппарата человека
АТФ-азная активность миозина
В 1939 году советскими учеными В.А. Энгельгардом и М.Н. Любимовой было установлено, что молекула миозина обладает АТФ-азной активностью, то есть участвует в реакции гидролиза АТФ – основной реакции энергообеспечения мышечной деятельности энергией. Позже было установлено, что на каждой миозиновой головке имеются центры. В одном из них находится фермент АТФ-аза. Другой центр предназначен для связывания головки миозина с тонким филаментом (рис.2).

Рис.2. Молекула миозина состоит из двух длинных полипептидов (тяжелых цепей), формирующих две глобулярные головки и стержнеобразный хвост, участвующий в образовании толстого филамента. Головки содержат актин-связывающие участки (А) и моторные области (М), где происходит связывание и расщепление АТФ. Вблизи головок с тяжелыми цепями ассоциированы две пары легких цепей, одна из которых содержит участок фосфорилирования (Ф).
В настоящее время на основе степени активности фермента АТФ-азы производится разделение мышечных волокон на типы.
Формирование толстого филамента
Несколько сотен миозиновых молекул способны самопроизвольно собираться в пучок. При таком объединении молекулы миозина располагаясь параллельно друг другу с некоторым сдвигом образуют своеобразный «ствол» (рис.2). Толщина «ствола» составляет 11-14 нм. В середине «ствола» переплетаются хвосты молекул миозина, а с двух концов «ствола» торчат головки. Это и есть толстый филамент (рис. 3 и рис.4).
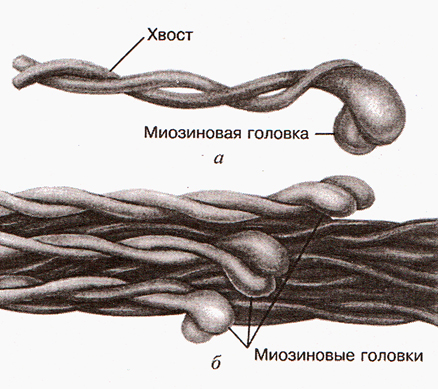
Рис.3. Молекула миозина и толстый филамент Рис.4. Толстый филамент
Рис.4. Толстый филамент
Установлено, что агрегация (самосборка) толстого филамента очень чуствительна к рН саркоплазмы. Если рН саркоплазмы находится вне физиологических значений (рН = 7,2-7,5), самосборка толстых филаментов происходит нерегулярно и возникают очень длинные разветвляющиеся структуры (Дж. Бендолл, 1970). Из этого следует, что синтез белков, пока в мышечных волокнах много молочной кислоты (лактата) отставлен, так как могут синтезироваться «неправильные» толстые филаменты, саркомеры и миофибриллы.
Более подробно строение и функции мышц описаны в моих книгах
«Гипертрофия скелетных мышц человека» и Биомеханика опорно-двигательного аппарата человека
- Бендолл Дж. мышцы, молекулы и движение.- М.: Мир, 1970.- 256 с.
- Самойлов В.О., Бигдай Е.В. Клеточные и молекулярные основы биомеханики / В кн.: Математические модели и компьютерное моделирование в биомеханике: Учебное пособие.- СПб: Из-во Политехнического ун-та, 2004.- С. 29-102.
Генетика
Клонирование кДНК MYBPC3 человека и локализация гена на хромосоме 11p11.2 человека способствовали структуре и функции cMyBP-C. Таким образом, MYBPC3 стал «лучшим» геном-кандидатом в локус CMH4 для гипертрофической кардиомиопатии, который первоначально был картирован группой Шварца. Были идентифицированы мутации MYBPC3, сегрегированные в семьях с гипертрофической кардиомиопатией . MYBPC3 , таким образом , был четвертый ген гипертрофической кардиомиопатии , после MYH7 , кодирующий β- тяжелой цепи миозина , TNNT2 и TPM1 , кодирующий сердечной тропонина Т и α- тропомиозин , соответственно, выделяя гипертрофической кардиомиопатии , как болезнь саркомера .
На сегодняшний день идентифицировано около 350 мутаций в MYBPC3 , и в значительной степени мутации приводят к усечению белка, сдвигам в рамках считывания и кодонам преждевременной терминации. Генетические исследования выявили значительное совпадение генотипов и фенотипов, поскольку мутации MYBPC3 могут приводить к различным формам кардиомиопатий, таким как дилатационная кардиомиопатия и некомпактная кардиомиопатия левого желудочка . У пациентов с изолированными или семейными случаями дилатационной кардиомиопатии мутации MYBPC3 представляли собой второе по величине количество известных мутаций. Кроме того, интронная делеция MYBPC3 длиной 25 пар оснований, приводящая к усечению белка, присутствует у 4% населения Южной Индии и связана с более высоким риском развития сердечной недостаточности. Мутации основателя MYBPC3 были зарегистрированы в Исландии, Италии, Нидерландах, Японии, Франции и Финляндии, где они составляют большой процент случаев гипертрофической кардиомиопатии. Все они являются усекающими мутациями, приводящими к более короткому белку, лишенному регуляторного фосфорилируемого М-мотива и / или основных связывающих доменов с другими саркомерными белками. Совокупность доказательств указывает на то, что пациенты с более чем одной мутацией часто развивают более тяжелый фенотип, и значительная часть гипертрофической кардиомиопатии с началом в детстве (14%) вызвана сложными генетическими вариантами. Это говорит о том, что эффект дозировки гена может быть ответственным за проявления в более молодом возрасте. Сообщалось в общей сложности о 51 случае гомозигот или сложных гетерозигот, большинство из них с двойным усечением мутаций MYBPC3 и связано с тяжелой кардиомиопатией, приводящей к сердечной недостаточности и смерти в течение первого года жизни.
Результаты
Концентрация гликогена, содержание жидкости и концентрации саркоплазматических белков за время тренировок существенно не изменились. Однако концентрации актина и миозина и активность цитратсинтазы к концу исследования значительно снизились (p = 0.035). Более того, хотя изменения концентрации саркоплазматических белков были несущественными, они имели тенденцию к росту (среднее изменение составило около 23%, p = 0.065), но сильно варьировали.
Обратите внимание: содержание сократительных белков не снижается. Сколько их было, столько и осталось
В химически окрашенных волокнах количество актина в одном волокне существенно не меняется. Однако волокно растет, что приводит к снижению концентрации актина. Также стоит отметить, что перед тренировкой и после трех недель занятий общее содержание актина было тесно связано с площадью поперечного сечения волокна (r2 = 0,815 перед тренировкой и 0,867 после трех недель тренировки). Однако через шесть недель достоверной связи между содержанием актина и площадью поперечного сечения волокна не было (r2 = 0.160; p = 0.22).
Несмотря на снижение концентраций актина и миозина, средние значения маркеров расщепления белка (активность протеасом 20S и содержание убиквитинированного белка) и повреждения мышц (активность креатинкиназы сыворотки) существенно не изменились.
Хотя общая концентрация белков саркоплазмы не увеличилась, концентрация отдельных белков возросла, в том числе связанных с гликолизом и глюконеогенезом.
У той семерки, которым делали дополнительную биопсию, площадь поперечного сечения через 8 дней после окончания тренировок вернулась к начальному уровню. В отличие от полной выборки из 15 человек, содержание саркопламатических белков у этой семерки значительно возросло к концу тренировочной программы и стало еще больше после недели отдыха. Соответственно, концентрации актина и миозина имели тенденцию к снижению.
Функции белков
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Первые слова из определения Ф.Энгельсом понятия жизни «Жизнь есть способ существования белковых тел, …. » до сих пор, по прошествии полутора веков, не потеряли своей правильности и актуальности.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности).
К данной функции можно отнести участие в создании органелл – рибосомы.
Ферментативная функция
Все ферменты являются белками. В то же время есть данные о существовании рибозимов, т.е. рибонуклеиновых кислот, обладающих каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки — Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови — например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
Белковая буферная система участвует в поддержании кислотно-щелочного состояния.
Существуют белки, которые являются предметом особого изучения:
Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению.
Резилин – обладает почти идеальной эластичностью, составляет „шарниры» в местах прикрепления крыльев насекомых.
Белки со свойствами антифриза обнаружены у антарктических рыб, они предохраняют кровь от замерзания
Патомеханизмы
Прекрасное понимание того, как мутации MYBPC3 приводят к развитию наследственной кардиомиопатии, пришло из анализа образцов миокарда человека, переноса генов в различных клеточных линиях, моделей естественных или трансгенных животных и недавнего моделирования заболеваний с использованием индуцированных плюрипотентных стволовых клеток ( ИПСК ). -производные сердечные миоциты. Хотя доступ к образцам миокарда человека затруднен, по крайней мере, некоторые исследования предоставили доказательства того, что усеченные cMyBP-Cs, возникающие в результате усечения мутаций MYBPC3 , не обнаруживаются в образцах пациентов-людей с помощью Вестерн-иммуноблот-анализа. Это предложение было поддержано в гетерозиготном Mybpc3 -targeted нокаут у мышей, неся человека c.772G> Переход (т.е. мутации основателя в Тоскане Эти данные свидетельствуют о том гаплонедостаточность в качестве основного механизма заболевания у гетерозиготных усечения мутаций. Совокупность доказательств существует , что механизмы регуляция экспрессии мутантного аллеля включает нонсенс-опосредованный распад мРНК , убиквитин-протеасомную систему (UPS) и аутофагию-лизосомный путь после переноса гена мутантного MYBPC3 в сердечные миоциты или у мышей in vivo . В отличие от усекающих мутаций, missense мутации приводят, в большинстве случаев (хотя их трудно специфически обнаружить), к стабильным мутантным cMyBP-C, которые, по крайней мере частично, включены в саркомер и могут действовать как ядовитые полипептиды в структуре и / или функции саркомера. Следовательно, гомозиготные или сложные гетерозиготные мутации, вероятно, подлежат дифференциальному регулированию в зависимости от того, являются ли они двойным миссенс, двойным усечением или двойным усечением. r смешанные миссенс / усекающие мутации. Гомозиготные мыши Mybpc3, нацеленные на нокаут, которые генетически имитируют ситуацию тяжелой неонатальной кардиомиопатии, рождаются без фенотипа, и вскоре после рождения у них развивается систолическая дисфункция с последующей (компенсаторной) гипертрофией сердца. Переход c.772G> A человека приводит к низким уровням трех различных мРНК Mybpc3 и cMyBP-C у гомозиготных мышей, что предполагает сочетание гаплонедостаточности и отравления полипептидами как механизма заболевания в гомозиготном состоянии. Кроме того, было показано , что сочетание внешнего стресса (например, нейрогуморального стресса или старения) и мутаций Mybpc3 нарушает UPS у мышей, а протеасомная активность также снижается у пациентов с гипертрофической кардиомиопатией или дилатационной кардиомиопатией .
Кожные трабекулы или сердечные миоциты, полученные от пациентов-людей, несущих мутацию MYBPC3, или от гетерозиготных и гомозиготных мышей, нацеленных на Mybpc3, демонстрировали более высокую чувствительность миофиламентов к Са2 +, чем контрольные. Моделирование заболеваний с помощью технологии инженерной ткани сердца ( EHT ) с сердечными клетками от гетерозиготных или гомозиготных Mybpc3- целевых мышей воспроизводило наблюдения, сделанные в исследованиях на людях и мышах, демонстрирующие сокращенные сокращения, большую чувствительность к внешнему Ca2 + и меньшую инотропную реакцию на различные лекарства ( изопреналин, EMD 57033 и верапамил) по сравнению с контрольными EHT дикого типа. Следовательно, EHT подходят для моделирования фенотипа заболевания и повторения функциональных изменений, обнаруженных у мышей с гипертрофической кардиомиопатией . Еще одна хорошая система для моделирования кардиомиопатий в чашке для культивирования клеток — это получение сердечных миоцитов из ИПСК . Отчеты о человеческих iPSC-моделях саркомерных кардиомиопатий показали клеточную гипертрофию в большинстве случаев, в том числе с мутацией c.2995_3010del MYBPC3, которая помимо гипертрофии проявляла вариабельность сократительной способности в присутствии эндотелина-1 .
Практическое применение и выводы
- Саркоплазматическая гипертрофия не миф, она реально существует.
- Выраженность саркоплазматической гипертрофии может зависеть от числа повторений (она особенно заметна при 8-10 и более повторах) и от количества подходов (чем их больше, тем сильнее выражена гипертрофия). Она может также зависеть от стажа тренировки, поскольку сильнее проявляется у более опытных атлетов. Этот вывод исходит из предположения, что саркоплазматическая гипертрофия стимулирует усиление анаэробного метаболизма.
- Нам нужно гораздо больше исследований, чтобы разобраться во всех деталях.
Этой фразой теперь заканчивается обсуждение практически любой научной статьи: «Необходимы дальнейшие исследования».