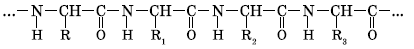Строение белков — особенности, функции, биологическая роль
Содержание:
- Функции белков
- Что такое цитохромы?
- Полноценные и неполноценные белки
- Особенности и типы липопротеидов
- Подробнее о протеогликанах
- Что такое белки
- Белковый электрофорез
- Классификация и характеристика сложных белков
- Функции хлорофилла
- Уровни организации белковых молекул
- Особенности и типы липопротеидов
- Быстрые и медленные белки: какие продукты их содержат
- У нас можно купить диетические продукты:
- Функции белка
- Функции белков
- Как распределить белок в течение дня
- Структура белков
- Особенности гликопротеинов и протеогликанов
- Классификация белков
- Сравнение с другими системами классификации
- Переваривание белков
- Вегетарианство и белок
- пример
Функции белков
Строение белков, все четыре структуры этих полимеров, обусловливают их функции. Каждый определенный белок выполняет и свою функцию, и общие задачи для этого класса веществ:
- Структурная — главнейшая задача данных полимеров. Данную функцию белки выполняют на различных уровнях организации живой материи. Но главным является то, что они входят в состав всех клеточных мембран. Отдельные представители — коллаген, эластин, керотин содержатся в перьях, волосах, коже и ногтях.
- Транспортная — не менее важная задача белков. Гемоглобин переносит кислород и углекислый газ в крови позвоночных. Гемоцианин выполняет аналогичные действия, но у беспозвоночных. Миоглобин транспортирует кислород к мышцам.
- Защитная — осуществление защиты от различных инфекций и вредоносных микроорганизмов. Выполняют эту задачу антитела крови, фибриноген, тромбин, способствующие процессам свертывания крови и образования тромбов. Каталаза препятствует развитию свободно-радикальных процессов, которые являются крайне вредоносными для человеческого организма.
- Ферментативная — белки катализируют практически все химические реакции, происходящие в клетке. Функцию выполняют трипсин и глутамин-синтетаза.
- Сократительная — актин и миозин участвуют в сокращении мышц.
- Регуляторная — количество определенных веществ регулируют инсулин, глюкагон и специальное сложное вещество — адренокортикотропин (АКТГ).
- Запасающая — питательные вещества запасают казеин молока, яичный альбумин.
- Токсичная — данную задачу выполняют особые белки-токсины, каковыми являются змеиный и дифтерийный яды.
- Энергетическая — самая незначительная и маловажная. За счет расщепления одного грамма белка выделяется 17,6 килоджоулей энергии.
Итак, разобрав строение белков, мы узнали, что они являются непериодическими биополимерами, состоящими из 20 аминокислот. Различные представители этого класса веществ могут иметь от одной до четырех структур, в каждой из которых преобладают свои виды связи. Белки, различающиеся по своей форме и количеству структур, имеют индивидуальные физические свойства и отдельные функции. Незаменимость белков для всех живых существ мы доказали при рассмотрении выполняемых ими задач.Для закрепления изученного материала рекомендуем пройти тест, расположенный ниже, и посмотреть видео.
Что такое цитохромы?
Как было описано выше, гем состоит из порфирина. В его структуру входят 4 пиррольных кольца и двухвалентное железо. Особая группа гемовых ферментов – цитохромы, различающиеся составом аминокислот и числом пептидных цепей, специализированы на проведении окислительно-восстановительных реакций, за счет которых обеспечивается перенос электронов в дыхательной цепи. Данные ферменты участвуют в микросомальном окислении – начальных реакциях биотрансформации ксенобиотиков, приводящих к их обезвреживанию, и обмене многих экзогенных и экзогенных веществ, например, стероидов, насыщенных жирных кислот.
Полноценные и неполноценные белки
В процессе усвоения белков из пищи они расщепляются на аминокислоты. Затем из этих аминокислот строятся необходимые организму белки. Таким образом, для вас важен не просто белок, а состав аминокислот.
Аминокислоты делятся на незаменимые и заменимые. Заменимые способны синтезироваться в организме человека. Незаменимые, напротив, поступают только с пищей. По этой причине, при нехватке какой-либо незаменимой аминокислоты определённый белок не будет создан, что в итоге приведёт к тем или иным последствиям.
Белки, которые содержат все незаменимые аминокислоты в необходимых количествах называют полноценными.
- белки яиц;
- печень;
- молоко и молочные продукты (кроме сметаны и сливочного масла);
- рыба и морепродукты;
- мясо, птица;
- соя.
Белки, которые содержат лишь некоторые из незаменимых аминокислот называют неполноценными.
- зерновые культуры;
- бобовые (кроме сои);
- орехи и семечки;
- овощи.
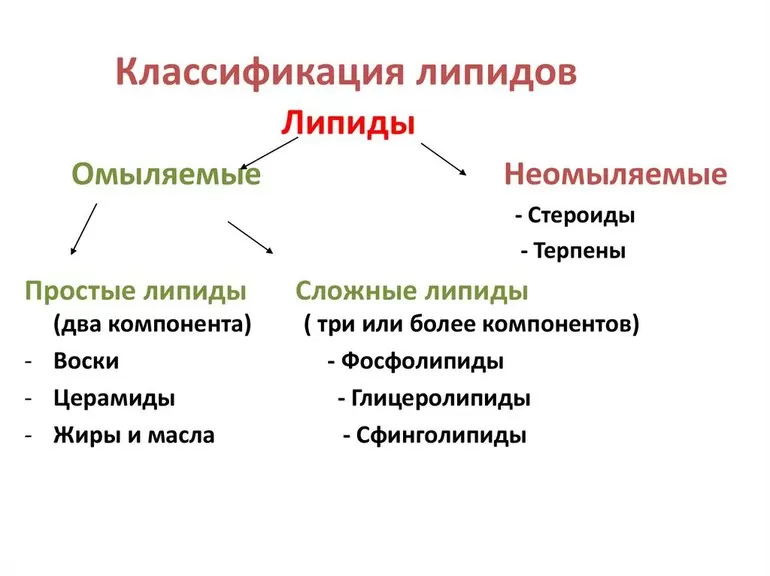
Особенности и типы липопротеидов
Сложный белок липопротеид отличается хорошо выраженной двойственной гидрофильной и гидрофобной природой. Ядро молекулы (гидрофобную часть) образуют неполярные эфиры холестерола и триацилглицериды.
Снаружи в гидрофильной зоне располагаются белковая часть, фосфолипиды, холестерол. Выделяют несколько разновидностей белков липопротеидов в зависимости от их структуры.
Основные классы липопротеидов:
- Сложный белок высокой плотности (ЛВП, α-липопротеины). Перемещает холестерин к печени и периферическим тканям.
- Низкой плотности (ЛНП, β-липопротеины). Кроме холестерина транспортируют триацилглицериды и фосфолипиды.
- Очень низкой плотности (ЛОНП, пре-β-липопротеины). Выполняют функцию, подобную ЛНП.
- Хиломикроны (ХМ). Транспортируют жирные кислоты и холестерин из кишечника после поступления пищи.
Такая сосудистая патология, как атеросклероз, возникает в результате неправильного соотношения разных типов липопротеинов в крови. По характеристике состава можно выявить несколько тенденций изменения структуры фосфолипидов (от ЛВП до хиломикронов): уменьшение доли белка (от 80 до 10%) и фосфолипидов, увеличение процента триацилглицеридов (от 20 до 90%).
Подробнее о протеогликанах
Обычно сложный белок протеогликан включает в свою структуру большие углеводные цепи с повторяющимися дисахаридными остатками, состоящими из какой-либо уроновой кислоты и аминосахара. Олиго- или полисахаридные цепи называются гликанами. Первые обычно содержат 2-10 мономерных единиц.
В зависимости от структуры углеводных цепей выделяют их различные типы, например, кислые гетерополисахариды с большим количеством кислотных групп или гликозаминогликаны, включающие аминогруппы. К последним относятся:
- Гиалуроновая кислота, которую активно применяют в косметологии.
- Гепарин, препятствующий свертываемости крови.
- Кератансульфаты – компоненты хрящевой ткани и роговицы.
- Хондроитинсульфаты входят в состав хряща и синовиальной жидкости.
Данные полимеры – компоненты протеогликанов, которые заполняют межклеточное пространство, удерживают воду, смазывают подвижные части суставов, являются их структурными составляющими. Гидрофильность (хорошая растворимость в воде) протеогликанов позволяет им в межклеточном пространстве создавать преграду для крупных молекул и микроорганизмов. С их помощью создается желеобразный матрикс, в который погружены волокна других важных белков, например, коллагена. Его тяжи в среде протеогликана имеют древовидную форму.
Что такое белки
С точки зрения биохимии — это высокомолекулярные органические полимеры, мономерами которых являются 20 видов различных аминокислот. Они соединяются между собой ковалентными химическими связями, иначе называемые пептидными. Так как мономеры белка являются амфотерными соединениями, они содержат как аминогруппу, так и карбоксильную функциональную группы. Химическая связь СО-NH возникает между ними.
Если полипептид состоит из остатков аминокислотных звеньев, он образует простой белок. Молекулы полимера, дополнительно содержащие ионы металлов, витамины, нуклеотиды, углеводы — это сложные белки. Далее мы рассмотрим пространственное строение полипептидов.
Белковый электрофорез
Белковый электрофорез — это исследование, которое состоит из разделения белков, обнаруженных в моче (мочевые белки) или сыворотке крови (сывороточные белки).
Это исследование, используемое для выявления отсутствия, уменьшения или увеличения количества белков, а также для выявления наличия аномальных белков. Этот тест помогает в диагностике заболеваний, которые влияют на поглощение, потерю и выработку белков.
Нерегулярное количество белка может указывать, например, на проблемы с почками, диабет, аутоиммунные заболевания и рак.
Измерение количества общих белков может также указывать на состояние питания человека.
Избыток белка в организме
Потребление белка должно быть умеренным, потому что в избытке это может привести к проблемам со здоровьем. Организм, имеющий избыточное количество белка, может страдать от повреждения почек (таких как камни) и развивать такие заболевания, как атеросклероз и остеопороз, увеличение веса и проблемы с печенью.
По этой причине необходимо быть очень осторожным, чтобы следовать так называемой «белковой диете» (диете, основанной на продуктах, которые являются хорошими источниками белков), так как потребление не может быть преувеличено.
Мало белка в организме
Если, с одной стороны, чрезмерное количество белка в организме вредно для организма, очень низкое количество также вредно.
Одним из эффектов, вызываемых низким содержанием белка в организме, является, например, атрофия части центральной нервной системы.
Кроме того, у индивидуума также может наблюдаться снижение веса, постоянное чувство усталости, мышечные боли, проблемы заживления, выпадение волос и т. Д.
Классификация и характеристика сложных белков
Эти вещества делятся на виды в зависимости от типа дополнительной группы. К сложным белкам относятся:
- Гликопротеины – белки, молекулы которых содержат углеводный остаток. Среди них выделяют протеогликаны (компоненты межклеточного пространства), включающие в свою структуру мукополисахариды. К гликопротеидам относятся иммуноглобулины.
- Липопротеиды включают липидный компонент. К ним относятся аполипопротеины, выполняющие функцию обеспечения липидного транспорта.
- Металлопротеины содержат ионы металлов (меди, марганца, железа и др.), связанные через донорно-акцепторное взаимодействие. В эту группу не входят гемовые белки, включающие соединения профиринового кольца с железом и подобные им по структуре соединения (хлорофилл, в частности).
- Нуклеопротеиды – белки, имеющие нековалентные связи с нуклеиновыми кислотами (ДНК, РНК). К ним относится хроматин – компонент хромосом.
- 5. Фосфопротеиды, к которым относится казеин (сложный белок творога), включают ковалентно соединенные остатки фосфорной кислоты.
Хромопротеины объединяет окрашенность простетического компонента. Данный класс включает гемовые белки, хлорофиллы и флавопротеиды.
Функции хлорофилла
Как мы уже упоминали ранее, сложные белки могут образовывать комплексы с пигментами – окрашенными органическими веществами. Их цвет зависит от хромоформных групп, которые избирательно поглощают определённые спектры солнечного света. В клетках растений есть зеленые пластиды – хлоропласты, содержащие пигмент хлорофилл. В его состав входят атомы магния и многоатомный спирт фитол. Они связаны с белковыми молекулами, а сами хлоропласты содержат тилакоиды (пластинки), или мембраны, связанные в стопки – граны. В них находятся фотосинтезирующие пигменты – хлорофиллы — и дополнительные каротиноиды. Здесь же находятся все ферменты, используемые в фотосинтетических реакциях. Таким образом, хромопротеиды, к которым относится и хлорофилл, выполняют важнейшие функции в обмене веществ, а именно в реакциях ассимиляции и диссимиляции.
Уровни организации белковых молекул
Они представлены четырьмя различными конфигурациями. Первая структура — линейная, она наиболее проста и имеет вид полипептидной цепи, во время её спирализации происходит образование дополнительных водородных связей. Они стабилизируют спираль, которая называется вторичной структурой. Третичный уровень организации имеют простые и сложные белки, большинство растительных и животных клеток. Последняя конфигурация — четвертичная, возникает при взаимодействии нескольких молекул нативной структуры, объединенных коферментами, именно такое строение имеют сложные белки, выполняющие в организме разнообразные функции.
Особенности и типы липопротеидов
Сложный белок липопротеид отличается хорошо выраженной двойственной гидрофильной и гидрофобной природой. Ядро молекулы (гидрофобную часть) образуют неполярные эфиры холестерола и триацилглицериды.
Снаружи в гидрофильной зоне располагаются белковая часть, фосфолипиды, холестерол. Выделяют несколько разновидностей белков липопротеидов в зависимости от их структуры.
Основные классы липопротеидов:
- Сложный белок высокой плотности (ЛВП, α-липопротеины). Перемещает холестерин к печени и периферическим тканям.
- Низкой плотности (ЛНП, β-липопротеины). Кроме холестерина транспортируют триацилглицериды и фосфолипиды.
- Очень низкой плотности (ЛОНП, пре-β-липопротеины). Выполняют функцию, подобную ЛНП.
- Хиломикроны (ХМ). Транспортируют жирные кислоты и холестерин из кишечника после поступления пищи.
Такая сосудистая патология, как атеросклероз, возникает в результате неправильного соотношения разных типов липопротеинов в крови. По характеристике состава можно выявить несколько тенденций изменения структуры фосфолипидов (от ЛВП до хиломикронов): уменьшение доли белка (от 80 до 10%) и фосфолипидов, увеличение процента триацилглицеридов (от 20 до 90%).
Быстрые и медленные белки: какие продукты их содержат
Существует несколько классификаций белковой пищи. Наиболее распространённая из них по происхождению (животные или растительные), но протеины можно разделить и по скорости усвоения:
- Медленные. Для их расщепления на аминокислоты требуется 6-8 часов. Калорий в этих веществах меньше, а энергия для переваривания требуется больше, поэтому они наиболее эффективны для похудения и на долгое время снижают чувство голода. Именно они содержатся в растительной пище.
- Быстрые. Усваиваются всего за 1-1,5 часа. Благодаря скорости усвоения, они позволяют быстро получить энергию и бодрость, помогают постепенному набору мышечной массы. К перечню таких продуктов относятся разнообразная пища животного происхождения.
Коэффициент усвоения в таблице рассчитывается с учетом входящих аминокислот и эффективности переваривания этой пищи. Чем выше значение этой характеристики, тем более насыщенным источником протеина является данная еда.
Для наращивания мышечной массы лучше использовать продукты, содержащие белок из «быстрой» части списка, а для похудения – из «медленной».
Для лучшего усвоения блюда и одного, и другого вида требуют дополнительной подготовки. Например, зерновые и злаки перед употреблением лучше замачивать. А мясо и рыба наиболее качественно перевариваются, если проходят умеренную термическую обработку и измельчение.
У нас можно купить диетические продукты:
Роль этих органических соединений огромна. В зависимости от вида и взаимного расположения аминокислот, каждое из них имеет свои особенности. В целом белки в организме могут выполнять следующие функции:
- С их помощью обеспечивается рост и развитие. Они присутствуют во всех клетках, тканях и межтканевых структурах. Эластин содержится в стенках капилляров. Коллаген можно найти в составе связок и сухожилий кожи и костей. А из кератинов состоят волосы и ногти.
- Именно эти соединения участвуют в образовании антител. Они связывают токсины и яды и обеспечивают свертываемость крови.
- При беременности в качестве основного источника питания для плода выступают казеин и альбумин.
- Благодаря им поддерживается нормальный уровень давления в клетках.
- Способствует сокращению и расслаблению мышц.
- Специальные белки-ферменты (например, пепсин) регулируют биохимические процессы. От них зависит метаболизм и усвоение не только самих протеинов, но и жиров, углеводов, витаминов и т. д.
- Гемоглобин, также имеющий протеиновые природу, выполняет транспортную функцию, которая заключается в снабжении всех клеток кислородом и другими веществами и выводом двуокиси углерода.
- Гормоны, регулирующий практически все процессы жизнедеятельности – также являются протеинами.
- И даже зрение напрямую зависит от белка родопсина, благодаря которому на сетчатке глаза и формируются изображение.
Функции белка
Помните, мы уже с вами говорили про основные функции белков? Обязательно почитайте.
Белки постоянно расходуются на нужды организма.
Они выполняют строительную, транспортную и защитную функцию, являются материалом для синтеза гормонов, ферментов, гемоглобина, а также синтезируют коллаген для суставов.
При их недостатке страдает мышечная масса, замедляются обменные процессы, снижается иммунитет и работоспособность.
Поэтому нам с вами необходимо ежедневно пополнять запасы белков, получая их с пищей.
Давайте вспомним некоторые моменты.
Белки выполняют в организме следующие важные функции:
Функции белков
Белки играют ключевую роль в организме. Они являются основой материала, который формирует органы и ткани, а также основой формирования костей, волос, зубов и т. Д.
Функция белка варьируется в зависимости от его формы и структуры. Практически все функции клеток должны быть опосредованы белками.
Проверьте некоторые из основных функций белков.
- Строить клетки.
- Действуют как ферменты и тем самым ускоряют химические реакции.
- Транспортные молекулы и ионы.
- Хранить вещества.
- Помогите движению клеток и тканей.
- Строить и восстанавливать ткани и мышцы.
- Участвовать в генной регуляции.
- Вызывать сокращение мышц за счет действия двух типов белка: миозина и актина .
- Защищать организм (антитела являются типами белков).
- Перенос кислорода (гемоглобин — это белок, который переносит кислород по организму).
- Обеспечить энергию.
- Закон о регулировании обмена веществ в виде гормонов.
Как распределить белок в течение дня
При составлении меню нужно чередовать белковую пищу растительного и животного происхождения.
Только тогда организм будет обеспечен всеми необходимыми микроэлементами. Чтобы поддержать баланс всех питательных веществ, лучше выбирать высокобелковую пищу.
Определив необходимое количество белка на день, его нужно разделить на 5 приемов пищи. В обед рекомендуется съедать больше всего – 45%, на завтрак и ужин – по 20%. В течение дня еще может быть 2-3 перекуса, на них нужно распределить оставшиеся 15%.
Думаю, вы понимаете, что это очень примерный план, всё зависит от ваших индивидуальных особенностей.
Структура белков
Что касается структуры молекулы белка, посмотрите, как ее можно классифицировать:
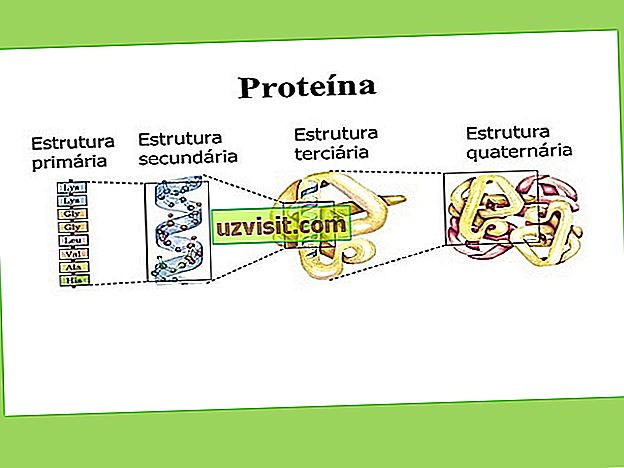
Первичная структура
Первичная структура определяется генетически. Это самая простая структура, где аминокислоты расположены линейно.
Вторичная структура
Для того чтобы структура белка была вторичной, первичная структура должна иметь ковалентно связанные аминокислоты. Таким образом, молекулы могут подвергаться вращению и, наконец, самостоятельно взаимодействовать тремя способами:
- Альфа-спираль : спиральная форма имеет место, когда возникают водородные связи между аминокислотами.
- Бета-листы : когда возникают водородные связи между аминокислотами и последующим образованием листа и жесткой структуры.
- Связи : являются нерегулярными структурами в ядре, и их образование происходит вне сворачивания белка.
Четвертичная структура
Эта структура имеет место посредством взаимодействия между одинаковыми или нет полипептидными цепями, которые группируются и образуют уникальную трехмерную структуру.
Особенности гликопротеинов и протеогликанов
Эти белки являются сложными веществами. Протеогликаны содержат большую долю углеводов (80-85%), у обычных гликопротеидов содержание составляет 15-20%. Уроновые кислоты присутствуют только в молекуле протеогликанов, их углеводы отличаются регулярным строением с повторяющимися звеньями. Какова структура и функции сложных белков гликопротеинов? Их углеводные цепи включают только 15 звеньев и имеют нерегулярное строение. В структуре гликопротеинов связь углевода с белковым компонентом обычно осуществляется через остатки таких аминокислот, как серин или аспаргин.

Функции гликопротеинов:
- Входят в состав клеточной стенки бактерий, костной соединительной и хрящевой ткани, окружают волокна коллагена, эластина.
- Играют защитную роль. Например, данную структуру имеют антитела, интерфероны, факторы свертываемости крови (протромбин, фибриноген).
- Являются рецепторами, которые взаимодействуют с эффектором – небольшой небелковой молекулой. Последняя, присоединяясь к белку, приводит к изменению его конформации, что приводит к определенному внутриклеточному ответу.
- Выполняют гормональную функцию. К гликопротеинам относится гонадотропный, адренокортикотропный и тиреотропный гормоны.
- Транспортируют вещества в крови и ионы через клеточную мембрану (трансферрин, транскортин, альбумин, Na+ ,К+ -АТФаза).
К гликопротеиновым ферментам относятся холинэстераза и нуклеаза.
Классификация белков
Белки делятся по своему внутреннему строению:
- Фибриллярные — в строении преобладает вторичная структура. Нерастворимы в воде, обладают высокой механической прочностью. Состоят из длинных полипептидных цепочек и имеют бета-слой. Входят в состав соединительной ткани (сухожилия, костная ткань). Таковыми являются коллаген, фиброин, керотин.
- Глобулярные — в строении преобладает третичная структура. Растворимы в воде, образуют коллоиды. Выполняют ферментативную, защитную (антитела), гормональную (инсулин, глюкагон) функции. Также благодаря им вода удерживается в цитоплазме.
- Промежуточные — имеют фибриллярную структуру. Во всех моментах схожи с фибриллярными белками, но имеют одно различие — растворимость в воде.
Белки подразделяются и по сложности строения:
- Простые — состоят только из аминокислот. Таковыми являются альбумины (в крови и яичном белке) и глобулины (в крови).
- Сложные — в строении, помимо аминокислот, имеют простетическую часть. Приведем примеры сложных белков: казеин молока, муцин (в слюне), нуклеопротеины (их образуют хромосомы), липопротеины, хромопротеины (состоят из железа и гемоглобина).
Мы разобрали все самые важные моменты строения белковых молекул. Нужно остановиться на последнем вопросе — функциях белков.
Рис. 6. Функции белков
Сравнение с другими системами классификации
Классификация SCOP больше зависит от ручных решений, чем полуавтоматическая классификация CATH , его главного конкурента. Человеческий опыт используется для определения того , некоторые белки являются эволюционно связаны между собой и , следовательно , должны быть отнесены к одной и той же надсемейства , или их сходство является результатом структурных ограничений , и , следовательно , они принадлежат к одной и той же складки . Другая база данных, FSSP , создается полностью автоматически (включая регулярные автоматические обновления), но не предлагает классификации, что позволяет пользователю сделать собственный вывод о значимости структурных отношений на основе попарных сравнений отдельных белковых структур.
Преемники SCOP
К 2009 году исходная база данных SCOP вручную классифицировала 38 000 записей PDB в строго иерархическую структуру. С ускоряющимся темпом публикаций по структуре белков ограниченная автоматизация классификации не успевала за ними, что привело к неполному набору данных. База данных расширенной структурной классификации белков (SCOPe) была выпущена в 2012 году с гораздо большей автоматизацией той же иерархической системы и полностью обратно совместима с SCOP версии 1.75. В 2014 году в SCOPe было повторно введено кураторство вручную, чтобы обеспечить точное распределение структуры. По состоянию на февраль 2015 года SCOPe 2.05 классифицировал 71 000 из 110 000 записей PDB.
Прототип SCOP2 был бета-версией Структурной классификации белков и системы классификации, которая была направлена на усиление эволюционной сложности, присущей эволюции структуры белков. Следовательно, это не простая иерархия, а направленная сеть ациклических графов, соединяющая суперсемейства белков, представляющих структурные и эволюционные отношения, такие как круговые перестановки , слияние доменов и распад доменов. Следовательно, домены не разделены строгими фиксированными границами, а скорее определяются их отношениями к наиболее похожим другим структурам. Прототип был использован для разработки базы данных SCOP версии 2. Версия 2 SCOP, выпущенная в январе 2020 г., содержит 5134 семейства и 2485 суперсемейств по сравнению с 3902 семействами и 1962 суперсемействами в SCOP 1.75. Уровни классификации организуют более 41 000 неизбыточных доменов, которые представляют более 504 000 белковых структур.
База данных эволюционной классификации белковых доменов (ECOD), выпущенная в 2014 году, аналогична расширению SCOPe версии 1.75 SCOP. В отличие от совместимого SCOPe, он переименовывает иерархию класса-свертка-суперсемейство-семейство в группу архитектура-X-гомология-топология-семейство (A-XHTF), причем последний уровень в основном определяется Pfam и дополняется кластеризацией HHsearch для некатегоризованных последовательностей. . ECOD имеет лучшее покрытие PDB среди всех трех преемников: он охватывает каждую структуру PDB и обновляется каждые две недели. Прямое сопоставление с Pfam оказалось полезным для кураторов Pfam, которые используют категорию уровня гомологии для дополнения своей «клановой» группировки.
Переваривание белков
Процесс переваривания белка начинается в желудке. Соляная кислота, присутствующая в ней, инициирует процесс, денатурируя белки, то есть разрушая водородные связи их структуры.
После этого протеолитические цепи теряют свою форму и подвергаются действию ферментов. В этот момент фермент пепсин заставляет белки превращаться в более мелкие молекулы, то есть пепсин вызывает частичную деградацию белка и гидролизует пептидные связи.
Вторая стадия переваривания белка происходит в тонкой кишке. В нем белки подвергаются действию панкреатических ферментов. После этого пептиды и аминокислоты поглощаются и попадают в печень.
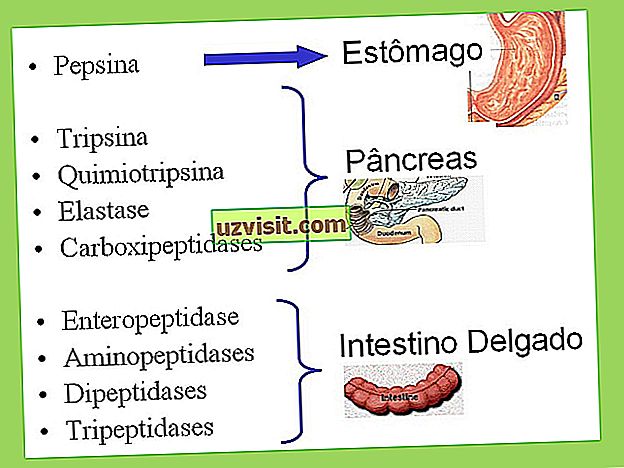
Ферменты, участвующие в переваривании белка
Процент белков, выделяемых организмом в виде фекалий, соответствует примерно 1% от потребляемого количества.
Вегетарианство и белок
Каждый человек самостоятельно делает выбор, как и чем ему питаться. В последние годы вегетарианство набирает популярность. Всё чаще из-за морально-этических убеждений люди отказываются от мяса, или вообще животной пищи.
Если говорить о здоровье, то вегетарианство с годами приводит к резкому дефициту многих витаминов и микроэлементов. Прежде всего, это касается веганов, которые полностью отказываются от животной пищи.
Им необходимо очень тщательно планировать свой рацион, чтобы обеспечить себя необходимым количеством незаменимых аминокислот. При правильном подходе заменить животный белок растительным можно.
К примеру, каши содержат мало аминокислоты лизин и много аминокислоты метионин. Фасоль, наоборот, много лизина и мало метионина. Так что употребляйте регулярно и то и другое. Хотя и необязательно в один приём пищи.
Вам рекомендуется употреблять разнообразные виды растительной пищи: крупы, бобовые (фасоль, чечевица, горох и нут), орехи, семечки, брокколи и др.
Читать подробнее: Вегетарианство. Как сохранить здоровье? Советы профессионалов
пример
Большинство страниц в SCOP содержат поле поиска. Ввод «трипсин + человек» возвращает несколько белков, включая белок трипсиноген, от человека. При выборе этой записи отображается страница, содержащая «происхождение», которое находится в верхней части большинства страниц SCOP.
- Линия трипсоногена человека
- Корень: область видимости
- Класс: Все бета-белки
- Сложить: трипсиноподобные сериновые протеазы
- бочка закрытая; n = 6, S = 8; греческий ключ
- дупликация: состоит из двух доменов одной складки
- Надсемейство: трипсиноподобные сериновые протеазы
- Семейство: эукариотические протеазы
- Белок: трипсин (оген)
- Вид: Человек (Homo sapiens)
Поиск «Субтилизин» возвращает белок «Субтилизин из Bacillus subtilis, carlsberg» со следующей линией.
- Субтилизин из Bacillus subtilis, линия Carlsberg
- Корень: область видимости
- Класс: альфа- и бета-белки (a / b)
- В основном параллельные бета-листы (блоки бета-альфа-бета)
- Складка: подобная субтилизину
- 3 слоя: а / б / а, параллельный бета-лист из 7 прядей, заказ 2314567; левостороннее кроссоверное соединение между нитями 2 и 3
- Надсемейство: субтилизиноподобные
- Семейство: Subtilases
- Белок: субтилизин
- Виды: Bacillus subtilis, carlsberg
Хотя оба эти белка являются протеазами, они даже не принадлежат к одной и той же складке, что согласуется с тем, что они являются примером конвергентной эволюции .