Мутации ras
Содержание:
- Как протекает процесс мутагенеза
- Мутация 677T и другие осложнения беременности
- Фолатный цикл
- С какими онкологическими заболеваниями связаны мутации в гене ALK?
- Сложность в том, что каждая опухоль уникальна по своему набору «мишеней»-мутаций
- Как проводят анализы на мутации HRR?
- Как мутации HRR влияют на выбор лечения?
- Распространенность аллеля 677T
- Что такое мутационная изменчивость
- Какие функции выполняют гены BRCA1 и BRCA2 в норме?
- Причины мутаций
Как протекает процесс мутагенеза
Механизм образования мутаций происходит так:
- повреждается ДНК. В случае, когда повреждение не восстановлено, происходит мутация;
- если при повреждении фрагмента ДНК и при вырождении генетического кода не происходит нарушения, то возникают мутации, которые впоследствии окажутся незначительными или вовсе не проявятся.
Мутант — это организм, во всех клетках которого произошли мутации. Он начинает развиваться из мутационной клетки — гаметы или зиготы. Часто мутация образуется не во всех соматических клетках — такой организм получил название генетическая мозаика.
В случае, если изменения произошли в генеративных клетках (гаметы, споры, клетки зародышевого пути), такой организм не будет считаться мутантом, но передаст часть мутаций наследникам.
Мутации возникают не сразу, т.к. их образованию предшествует предмутационное состояние. Репарационные системы стараются убрать такое состояние.
Определение
Репарационные системы — это ферменты и ферментативные реакции, способствующие восстановлению правильной структуры ДНК.
Репарационные системы основаны на разных ферментах, заключенных в генотипе клетки. Они препятствуют возникновению мутаций.
Мутация 677T и другие осложнения беременности
Женщины с генотипом 677TT склонны к развитию витаминодефицитного состояния по фолиевой кислоте. У небеременных женщин, гомозиготных по данному аллелю, фолатный дефицит может обнаруживаться только в эритроцитах, а уровень фолатов в плазме может быть не нарушен. Однако во время беременности у гомозиготных женщин отмечается снижение концентрации фолатов не только внутри эритроцитов, но и в плазме крови.
Исследования показали повышение риска развития нефропатии у беременных с сосудистыми заболеваниями. Это хорошо согласуется с данными о влиянии высоких концентраций гомоцистеина в крови с риском развития нефропатии у беременных. Кроме того было показано, что концентрация гомоцистеина в крови коррелирует с концентрацией фибронектина в клетках, что указывает на важную роль гомоцистеина в развитии эндотелиальной дисфункции при беременности. Повышение частоты аллеля 677T было отмечено не только при позднем токсикозе (гестозе), но и при других осложнениях беременности (отслойке плаценты, задержке роста плода, антенатальной смерти плода). Сочетание аллеля 677T с другими факторами риска приводит к повышению риска раннего выкидыша. Добавление фолиевой кислоты в рацион значительно снижает риск развития осложнений беременности. Профилактическое значение добавления фолиевой кислоты в рацион особенно выражено при наличии гипергомоцистеинемии.
Фолатный цикл
Фермент 5,10-метилентетрагидрофолат-редуктаза относится к группе флавопротеинов и состоит из двух одинаковых субъединиц с молекулярной массой около 70 кДа. MTHFR является ключевым ферментом фолатного цикла. Фолат и фолиевая кислота (синтетический витамин, отсутсвующий в естественных продуктах) являются двумя формами семейства веществ, связанных с птероилглютаминовой кислотой (ПтеГлу). Эта кислота является сложной молекулой, состоящей из птероидной кислоты и одного (моноглютаматы) или нескольких (до 9, полиглютаматы) остатков глютаминовой кислоты (см. рис. 1). Пища, особенно свежая зелень, печень, дрожжи и некоторые фрукты в основном содержат восстановленные полиглютаматы, которые должны быть гидролизованы с помощью фермента птероилполиглютамат-гидролазы до моноглютамата, чтобы они могли быть абсорбированы в проксимальном отделе тонкого кишечника. После всасывания фолат-моноглютамат быстро восстанавливается до тетрагидрофолата, поскольку только восстановленные формы фолата обладают биологической активностью. После метилирования фолаты поступают в кровь в виде 5-метилтетрагидрофолата. Кроме пищи, постоянное поступление 5-метилтетрагидрофолата обеспечивается кишечно-печеночным циклом: птерил-моноглютамат всасывается из кишечника и поступает в печень, где он восстанавливается и метилируется до 5-метилтетрагидрофолата. Образовавшийся 5-метилтетрагидрофолат выделяется с желчью в кишечник, где он затем всасывается и разносится с кровью по всему организму.
Рис. 1. Фолатный цикл и цикл метионина.
В ткани поступление 5-метилтетрагидрофолата внутрь клетки происходит с помощью эндоцитоза при участии специфических фолатных рецепторов. Описаны три изоформы фолатных рецепторов. Внутри клетки 5-метилтетрагидрофолат служит донором метильных групп и основным источником тетрагидрофолата. Последний выступает в качестве акцептора большого числа моноуглеродных групп, превращаясь в разные виды фолатов, служащих в свою очередь специфическими коферментами в целом ряде внутриклеточных реакций. К ним относятся 5-формилтетрагидрофолат (фолиниевая кислота, лейковорин), 10-формилтетрагидрофолат и 5,10-метилентетрагидрофолат.
Одной из реакций, требующих наличия 5,10-метилентетрагидрофолата и 5-метилтетрагидрофолата, является синтез метионина из гомоцистеина (путь реметилирования в обмене гомоцистеина). В этой реакции MTHFR играет ключевую роль, восстанавливая 5,10-метилентетрагидрофолат до 5-метилтетрагидрофолата, являясь таким образом катализатором единственной внутри клетки реакции образования 5-метилтетрагидрофолата. Хотя в сыворотке и других тканевых жидкостях обнаруживаются разные формы фолатов, главной формой фолата в плазме является 5-метилтетрагидрофолат, несущий на себе метильную группу, необходимую для превращения гомоцистеина в метионин. В этой реации метильная группа вначале переносится на коб(I)аламин (форма витамина B12), превращая его в метилкобаламин, который затем отдает метильную группу гомоцистеину, образуя метионин с помощью фермента метионин-синтазы. Однако в некоторых случаях коб(I)аламин может окисляться в коб(II)аламин, что приводит к подавлению метионин-синтазы. Для поддержания активности фермента необходимо восстановительное метилирование с помощью фермента метионин-синтаза-редуктазы.
Поскольку кобаламин (витамин B12) служит акцептором метильной группы 5-метилтетрагидрофолата, дефицит этого витамина приводит к «ловушке для фолата». Это тупиковый путь метаболизма, поскольку метилтетрагидрофолат не может при этом восстанавливаться до тетрагидрофолата и возвращаться в фолатный пул. Неспособность регенирировать метионин приводит к истощению запаса метионина и выбросу в кровь избытка гомоцистеина.
Рис. 2 C677T-полиморфизм 5,10 метилентетрагидрофолат-редуктазы (MTHFR) влияет на распределение соединений фолиевой кислоты (выделены зеленым цветом), используемых для синтеза ДНК и РНК, и 5-метилтетрагидрофолата, необходимого для реметилирования гомоцистеина (Hсy), а, значит, — для синтеза белка. Секторная диаграмма показывает распределение генотипов, типичное для европейских популяций, а размеры стрелок показывают относительную ферментную активность MTHFR.
С какими онкологическими заболеваниями связаны мутации в гене ALK?
В настоящее время известно, что изменения в этом гене встречаются не только при анапластической крупноклеточной лимфоме, но и при ряде других злокачественных опухолей: нейробластоме, немелкоклеточном раке легкого, почечно-клеточном раке, плоскоклеточном раке пищевода.
Мутации ALK при немелкоклеточном раке легкого
Генетические перестройки с участием ALK встречаются в 3–7% случаев при немелкоклеточном раке легкого. Причем, чаще всего эти мутации обнаруживаются у определенных категорий пациентов:
- люди, которые не являются курильщиками или курят редко, немного;
- больные молодого возраста;
- пациенты со злокачественными опухолями легких, которые по результатам гистологического исследования относят к аденокарциномам;
- женщины;
- известно, что мутации ALK практически никогда не встречаются вместе с мутациями EGFR и KRAS.
Например, в 13% случаев при аденокарциномах легкого присутствует транслокация (перемещение участка одной хромосомы на другую) и/или химерный ген EML4-ALK. Ген EML4 кодирует белок, подобный ассоциированному с микротрубочками иглокожих белку. Такая связь приводит к чрезмерной активации ALK.
В каких случаях назначают анализ на мутации ALK при раке легкого, и для чего это нужно?
В соответствии с рекомендациями Международной ассоциации по изучению рака легких (IASLC) и Европейского общества медицинской онкологии (ESMO), у всех пациентов с аденокарциномой легких на поздних стадиях необходимо проводить анализы на мутации ALK. Обычно их назначают вместе с анализом на мутации EGFR или после него, если он показал отрицательный результат.
Исследование на мутации ALK помогает разобраться, будет ли эффективно лечение таргетными препаратами — ингибиторами рецепторной тирозинкиназы ALK: кризотинибом (Ксалкори), церитинибом (Зикадия), алектинибом (Алеценза). Эти препараты помогают более успешно бороться с запущенным ALK-положительным немелкоклеточным раком легкого, повысить выживаемость.
Мутации в гене ALK при нейробластоме
Нейробластомами называют злокачественные опухоли из незрелых нервных клеток, нейробластов. Они могут развиваться в разных частях тела: головном мозге, нервной ткани шеи, грудной клетки, брюшной полости, таза, надпочечников. Чаще всего нейробластомы диагностируют у детей младше 5 лет. На данный момент известно по крайней мере 16 видов генетических дефектов с вовлечением гена ALK, которые встречаются у таких пациентов. Эти мутации могут быть как соматическими, при спорадических случаях заболевания, так и наследственными, связанными с наследственной формой нейробластомы.
Одна из наиболее распространенных мутаций ALK при нейробластоме — замена аминокислоты аргинина на глутамин в положении 1275. Она обозначается как Arg1275Gln или R1275Q и бывает как наследственной, так и соматической.
В некоторых случаях встречается увеличение копий гена ALK — амплификация. За счет этого он становится чрезмерно активным. Сигнальный путь постоянно находится во «включенном» состоянии, и ему больше не требуется стимуляции извне.
Мутации в гене ALK при анапластической крупноклеточной лимфоме
Анапластическая крупноклеточная лимфома (АККЛ) — редкая агрессивная разновидность неходжкинских периферических T-клеточных лимфом, злокачественных опухолей из лимфоидной ткани. Слово «T-клеточная» в названии говорит о том, что нарушение произошло в T-лимфоцитах, а «периферическая» — то, что эти клетки циркулируют в периферической крови. АККЛ составляет 3% от всех лимфом у взрослых и 10–20% у детей. Мутации в гене ALK при этом заболевании играют настолько важную роль, что они даже легли в основу его классификации на два подтипа: выделяют ALK-положительные и ALK-отрицательные АККЛ.
Наибольшее значение при анапластических крупноклеточных лимфомах имеют хромосомные изменения с образованием химерных генов. В 70–80% случаев при ALK-положительных АККЛ определяется химерный ген, образованный генами ALK и NPM. Последний кодирует нуклеофозмин — белок, который участвует в регуляции деления клеток, репарации («починки») ДНК, транскрипции (синтеза РНК на матрице ДНК) и стабильности генома. За счет соединения двух генов активность ALK сильно повышается.
В остальных 20–30% случаев формирование химерного антигена происходит с другими генами, такими как ALO17, TFG, MSN, TPM3, TPM4, ATIC, MYH9, CLTC.
Сложность в том, что каждая опухоль уникальна по своему набору «мишеней»-мутаций
Так же, как уникален код ДНК у каждого человека — неповторимы и опухоли. Ведь они «рождены» из собственных клеток организма. Не существует опухолей с одинаковыми генно-молекулярными свойствами. Поэтому создать универсальную «таблетку» от рака — принципиально невозможно. Рак — слишком индивидуальное заболевание.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
Чтобы эффективно использовать таргетную терапию, этого мало. Врач должен знать, какие мутации есть в опухолевых клетках у конкретного пациента, присутствуют ли в них биомаркеры-«мишени» для того или иного препарата. Персонализированная медицина, как она есть.
Для этого мы и применяем молекулярно-генетические исследования. Чтобы найти «мишени», по которым нужно прицельно бить таргетными и иммунотреапевтическими препаратами — нужно определить, из каких генов собрана ДНК опухоли, и какие гены в ней — «сломаны». В результате:
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Там из образца выделяют опухолевую ДНК и секвенируют ее. То есть — «прочитывают» последовательность «букв»-нуклеотидов. А затем сравнивают с диагностической панелью, отобранной из базы библиотек — уже расшифрованных геномов тысяч других людей. Панель подбирают под каждого пациента — с учетом анамнеза и клинических данных. Все это, разумеется, делают автоматические секвенаторы и компьютер.
И если 20 лет назад «чтение» генома занимало месяцы, требовало медленной и сложной расшифровки, то сегодня в лаборатории, с которой мы сотрудничаем, делают анализ за несколько рабочих дней.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
Как проводят анализы на мутации HRR?
Для исследования можно использовать кровь (в ней присутствуют клетки и их ДНК) или образцы опухолевой ткани. Допустимо исследовать гистологический материал, который был получен ранее и хранится в лаборатории, но не более пяти лет. Однако, свежие ткани более предпочтительны.
Объем анализа может быть разным. Например, в некоторых случаях врачи назначают тестирование только на мутации BRCA1 и BRCA2 или BRCA1/2 и ATM.
Важно понимать, что в крови будут обнаружены только наследственные мутации, которые присутствуют во всех клетках тела. Чтобы обнаружить соматические мутации, произошедшие только в опухолевых клетках, нужно изучить образцы опухолевой ткани
Поэтому зачастую рекомендуется отправить в лабораторию и кровь, и гистологический материал.
Например, согласно результатам зарубежных исследований, при кастрационно-резистентном раке простаты мутации по крайней мере в одном гене HRR в образцах опухолевой ткани обнаруживаются у 27% пациентов, а при анализах крови — у 14%. Таким образом, на наследственные и соматические мутации приходится примерно по 50%.
Выявлять изменения в генах HRR можно разными способами. Наиболее современная методика — секвенирование следующего поколения (NGS). Эта технология позволяет «прочитать» всю последовательность ДНК и обнаружить максимум ошибок.
Как мутации HRR влияют на выбор лечения?
Мутации в генах HRR могут предсказать реакцию злокачественной опухоли на те или иные виды терапии и указать на чувствительность к определенным таргетным препаратам.
Так, у пациентов с наследственными мутациями BRCA1/2 терапия препаратами платины сопровождается более хорошим объективным ответом по сравнению с таксанами при раке молочной железы (68% и 33% соответственно) и более высокими показателями общей выживаемости по сравнению с другими химиопрепаратами при раке поджелудочной железы (22 месяца и 9 месяцев соответственно).
При злокачественных опухолях с мутациями HRR успешно применяется таргетный препарат олапариб (Линпарза). Он является ингибитором поли(АДФ-рибоза)-полимеразы (PARP). Этот фермент участвует в регуляции клеточного цикла, транскрипции и репарации ДНК. Когда олапариб блокирует PARP, в ДНК возникают повреждения, которые не могут быть исправлены, и клетка погибает.
Список показаний к терапии олапарибом довольно широк:
- Поддерживающее лечение при распространенном эпителиальном раке яичников, фаллопиевых труб и первичных опухолях брюшины с наследственными или соматическими мутациями BRCA, при полном или частичном ответе на препараты платины в качестве терапии первой линии.
- Поддерживающее лечение при рецидиве эпителиального рака яичников, фаллопиевых труб и первичных опухолях брюшины, при полном или частичном ответе на препараты платины.
- Поддерживающее лечение в сочетании с бевацизумабом (Авастин) при прогрессирующем эпителиальном раке яичников, фаллопиевых труб и первичных опухолях брюшины с наследственными или соматическими мутациями BRCA, при полном или частичном ответе на препараты платины в качестве терапии первой линии.
- Лечение при метастатическом HER2-негативном раке молочной железы с наследственными мутациями BRCA, если ранее проводилась адъювантная, неоадъювантная химиотерапия, или химиотерапия по поводу метастатического рака.
- Поддерживающее лечение при метастатическом раке поджелудочной железы с мутациями BRCA, если ранее заболевание не прогрессировало минимум 16 недель на фоне химиотерапии препаратами платины.
- Лечение при метастатическом кастрационно-резистентном раке предстательной железы с мутациями HRR, если заболевание прогрессирует после терапии энзалутамидом или абиратероном.
Федеральная сеть клиник «Евроонко» сотрудничает с ведущими мировыми лабораториями, благодаря чему у нас есть возможность проводить все виды генетических исследований, подбирать для пациентов персонализированную терапию. В клиниках всегда в наличии оригинальные противоопухолевые препараты последних поколений.
Запись на консультацию круглосуточно
+7 (495) 151-14-53+7 (861) 238-70-54+7 (812) 604-77-928 800 100 14 98
Распространенность аллеля 677T
Аллель 677T широко распространен в популяции. Частота гомозиготности составляет около 10—12%, а гетерозиготности — около 40% у европейской расы. Существуют значительные межрасовые и межэтнические различия. Чаще всего ген встречается у европейцев, реже всего — у чернокожих африканцев, и аборигенов Австралии и Шри-Ланки.
В Европе наименьшая частота аллеля 677T обнаруживается у скандинавов, а наибольшая — у южан (жителей Средиземноморья). Независимо от региона, наличие аллеля 677T связано с повышением уровня гомоцистеина плазмы, у гомозигот это повышение выражено в гораздо большей степени, чем у гетерозигот.
Высокая частота аллеля 677T предполагает, что носители данной мутации могли иметь определенные преимущества в естественном отборе
Существует гипотеза, что во время голода снижение активности MTHFR приводит к снижению реметилирования гомоцистеина, и таким образом сберегает моноуглеродные радикалы тетрагидрофолатного метаболизма для жизненно важного синтеза ДНК и РНК. Согласно другой гипотезе, носители мутантного аллеля имеют меньшую вероятность заболевания раком толстой кишки, в результате чего частота мутации в популяции может постепенно возрастать
Что такое мутационная изменчивость
Определение
Изменчивость, образованная в результате изменений генотипа под влиянием факторов внешней или внутренней среды, называется мутационной.
Мутационная изменчивость вызвана воздействием на организм мутагенов, приводящие к специфическим изменениям, т.е. реорганизации репродуктивного строения клетки.
Мутационную теорию разработал в 1901-1903 гг. голландский ботаник Гуго Де Фриз. Сущность концепции заключалась в следующем:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут
- Мутации образуются случайно в качестве дискретных изменений признаков.
- Они передаются в последующие поколения, в чем заключается их отличие от ненаследственных изменений.
- Изменения бывают вредными и полезными, доминантными и рецессивными.
- Обнаружить их можно при исследовании значительного количества особей.
- Они носят спонтанный характер: склонность к ним имеет любой участок хромосомы.
- Сходные мутации могут образоваться повторно.
Генотипическая, т.е. наследственная изменчивость является основой для возникновения разнообразных индивидуальных отличий, включающих в себя:
- качественные различия, не взаимосвязанные друг с другом, а также количественные различия, которые образуют непрерывные ряды, где близко расположенные элементы минимально отличаются друг от друга;
- изменения конкретного признака (независимая изменчивость) или изменения ряда черт (коррелятивная изменчивость);
- изменения с приспособительным значением, т.е. адаптивные, и «безразличные» — неадаптивные, способные снизить жизнеспособность носителя.
Каждый тип наследственных мутаций представляет собой эволюционный процесс.
Примечание
В отдельном организме наследственные признаки определяются не только теми генами, которые за них ответственны, но и характером взаимодействия с другими генами, входящих в генотип. Также учитываются внешние условия, в которых находился организм в процессе своего развития.
Какие функции выполняют гены BRCA1 и BRCA2 в норме?
Гены BRCA1 и BRCA2 находятся в разных хромосомах — соответственно в длинном плече (q) хромосомы 17 в положении 21.31 и в длинном плече (q) хромосомы 13 в положении 13.1. Но они выполняют схожие функции.
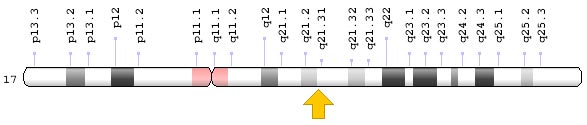
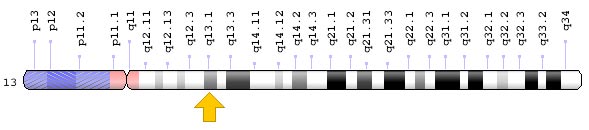
Оба белка, которые кодируются этими генами, устраняют двунитевые разрывы ДНК посредством гомологичной рекомбинации. Все хромосомы в клетках человека парные. Когда в одной из хромосом повреждены обе нити ДНК, сестринская хромосома «жертвует» ей одну цепочку аналогичного фрагмента своей ДНК, и по ней, как по шаблону, восстанавливается вторая цепочка.
Гены BRCA играют важную роль в этом процессе. Они являются генами-супрессорами опухолей. Если в них происходят мутации, геном становится нестабильным. Из-за накопившихся генетических дефектов нормальная клетка превращается в опухолевую и дает начало злокачественному новообразованию.
Причины мутаций
Мутации делятся на спонтанные и индуцированные.
Спонтанные мутации возникают самопроизвольно на протяжении всей жизни организма в нормальных для него условиях окружающей среды с частотой около 10−9{\displaystyle 10^{-9}} — 10−12{\displaystyle 10^{-12}} на нуклеотид за клеточную генерацию организма.
Индуцированными мутациями называют наследуемые изменения генома, возникающие в результате тех или иных мутагенных воздействий в искусственных (экспериментальных) условиях или при неблагоприятных воздействиях окружающей среды.
Мутации появляются постоянно в ходе процессов, происходящих в живой клетке. Основные процессы, приводящие к возникновению мутаций — репликация ДНК, нарушения репарации ДНК, транскрипции и генетическая рекомбинация.
Связь мутаций с репликацией ДНК
Многие спонтанные химические изменения нуклеотидов приводят к мутациям, которые возникают при репликации. Например, из-за дезаминирования цитозина напротив гуанина в цепь ДНК может включаться урацил (образуется пара У-Г вместо канонической пары Ц-Г). При репликации ДНК, напротив урацила в новую цепь включается аденин, образуется пара У-А, а при следующей репликации она заменяется на пару Т-А, то есть происходит транзиция (точечная замена пиримидина на другой пиримидин или пурина на другой пурин).
Связь мутаций с рекомбинацией ДНК
Из процессов, связанных с рекомбинацией, наиболее часто приводит к мутациям неравный кроссинговер. Он происходит обычно в тех случаях, когда в хромосоме имеется несколько дуплицированных копий исходного гена, сохранивших похожую последовательность нуклеотидов. В результате неравного кроссинговера в одной из рекомбинантных хромосом происходит дупликация, а в другой — делеция.
Связь мутаций с репарацией ДНК
Спонтанные повреждения ДНК встречаются довольно часто, такие события имеют место в каждой клетке. Для устранения последствий подобных повреждений имеются специальные репарационные механизмы (например, ошибочный участок ДНК вырезается и на этом месте восстанавливается исходный). Мутации возникают лишь тогда, когда репарационный механизм по каким-то причинам не работает или не справляется с устранением повреждений. Мутации, возникающие в генах, кодирующих белки, ответственные за репарацию, могут приводить к многократному повышению (мутаторный эффект) или понижению (антимутаторный эффект) частоты мутирования других генов.
Так, мутации генов многих ферментов системы приводят к резкому повышению частоты соматических мутаций у человека, а это, в свою очередь, приводит к развитию пигментной ксеродермы и злокачественных опухолей покровов. Мутации могут появляться не только при репликации, но и при репарации — эксцизионной репарации или при пострепликативной.