Гетерозиготный
Содержание:
- Когда нужен тест?
- Примеры
- Понятие о генах. Аллельные гены. Гомозиготы и гетерозиготы
- Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
- Гетерозиготное определение
- Мутация гена протромбина G20210A
- ЦИР рекомендует
- Что такое гомозиготный организм в биологии: определение, свойства
- Что такое мутационная изменчивость
- Аутосомный рецессивный признак
- Полиморфизм гена MTHFR
- Полиморфизм гена фактора V: лечится или нет
Когда нужен тест?
Исследование может быть необходимо до того, как проявится симптоматика в том случае, когда в истории семьи была мажорирована наследовавшаяся патология, которая проявляется в более позднем возрасте (к примеру, рак молочной железы, болезнь Хантингтона). Тест определяет уровень риска развития нарушения, следовательно, человек в будущем сможет принять превентивные меры. Когда тест продемонстрировал, что человек выступает носителем нарушения, тогда он тоже может принимать решения, которые касаются рождения потомства.
Предродовой тест также может включать амниоцентез, исследование крови пуповины, взятие пробы ворсин хориона, обследование материнской крови, тест эмбрионального воплощения или материнской сыворотки. Распространенные причины для предродового обследования это:
- возраст роженицы (старше тридцати пяти лет);
- семейная история нарушения, которую можно диагностировать при помощи предродовых методов;
- отклонения от нормальных показателей в результатах исследования материнской сыворотки, а также определенная симптоматика, проявляющаяся вовремя беременности.
Обследование новорожденного дает возможность осуществить профилактику (специальную диету или терапию замены) галактозного диабета, фенилпировиноградной олигофрении, а также гипотиреоза.
Также текст сегодня используют для создания семейной генеалогии. В современной генетической консультации широко используется создание семейной генеалогии (генеалогическое древо). При этом применяются условные символы, которые обозначают членов семьи и дают необходимые данные о состоянии их здоровья. Определенные семейные нарушения с похожими фенотипами обладают несколькими моделями наследования.
Примеры
- Фенилкетонурия . Поскольку фенилкетонурия была первым генетическим заболеванием, на которое был доступен массовый послеродовой генетический скрининг, с начала 1960-х годов атипичные случаи были обнаружены почти сразу. Молекулярный анализ генома еще не был возможен, но секвенирование белков выявило случаи, вызванные гетерозиготностью соединения. Когда в 1980-х и 1990-х годах стали доступны молекулярные геномные методы, стало возможным объяснить ряд нарушений у гетерозигот, несущих одну копию одной из классических мутаций фенилкетонурии.
- Болезнь Тея – Сакса . В дополнение к своей классической детской форме болезнь Тея-Сакса может проявляться в ювенильных или взрослых формах, часто в результате сложной гетерозиготности между двумя аллелями, одна из которых вызывает классическое инфантильное заболевание у гомозигот, а другая допускает некоторую остаточную активность фермента HEXA.
- Серповидноклеточные синдромы . Множество серповидно-клеточных заболеваний возникает в результате наследования гена серповидноклеточных клеток сложным гетерозиготным образом с другими мутантными генами бета-глобина. Эти нарушения включают серповидноклеточную бета-талассемию . В случае серповидно — клеточной анемии , человек с одним аллелем для гемоглобина S и один аллель для гемоглобина C будетпрежнему развиваться болезни, несмотрятогетерозиготных для обоих генов.
Понятие о генах. Аллельные гены. Гомозиготы и гетерозиготы
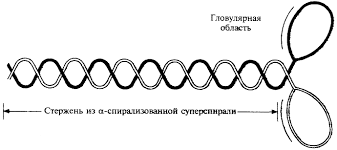
Одним из уровней организации живойматерии является ген– фрагментмолекулы нуклеиновой кислоты, в которомопределенной последовательностьюнуклеотидов заложены качественные иколичественные характеристики одногопризнака.
Элементарным явлением,обеспечивающим вклад гена в сохранениенормального уровня жизнедеятельностиорганизма, является самовоспроизведениеДНК и перенос заключенной в ней информациив строго определенную последовательностьнуклеотидов транспортной РНК.
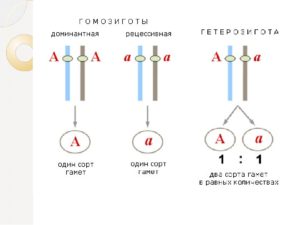
Аллельные гены– гены, определяющиеальтернативное развитие одного и тогоже признака и расположенные в идентичныхучастках гомологичных хромосом. Итак,гетерозиготные особи имеют в каждойклетке два гена – А и а, отвечающих заразвитие одного и того же признака.
Такие парные гены называют аллельнымигенами или аллелями. Любой диплоидныйорганизм, будь то растение, животноеили человек, содержит в каждой клеткедва аллеля любого гена. Исключениесоставляют половые клетки – гаметы.
Врезультате мейоза в каждой гаметеостается один комплект гомологичныххромосом, поэтому любая гамета имеетлишь по одному аллельному гену. Аллелиодного гена располагаются в одном и томже месте гомологичных хромосом.Схематически гетерозиготная особьобозначается так: А/а.
Гомозиготныеособи при подобном обозначении выглядяттак: А/А или а/а, но их можно записать икак АА и аа.
Гомозигота— диплоидный организмили клетка, несущий идентичные аллелив гомологичных хромосомах.
Грегором Менделем впервые был установленфакт, свидетельствующий о том, чторастения, сходные по внешнему виду,могут резко отличаться по наследственнымсвойствам. Особи, не дающие расщепленияв следующем поколении, получили названиегомозиготных.
Гетерозиготными называют диплоидныеили полиплоидные ядра, клетки илимногоклеточные организмы, копии геновкоторых в гомологичных хромосомахпредставлены разными аллелями. Когдаговорят, что данный организм гетерозиготен(или гетерозиготен по гену X), это означает,что копии генов (или данного гена) вкаждой из гомологичных хромосом несколькоотличаются друг от друга.
20. Понятие о гене. Свойства гена. Функции гена. Виды генов
Ген— структурная и функциональнаяединица наследственности, контролирующаяразвитие определённого признака илисвойства. Совокупность генов родителипередают потомкам во время размножения.
Свойства гена
-
Аллельное существование – гены могут существовать как минимум в двух разных формах; соответственно парные гены называются аллельными.
Аллельные гены занимают одинаковыеместа в гомологичных хромосомах. Местогена в хромосоме называют локусом.Аллельные гены обозначают одинаковойбуквой латинского алфавита.
-
Специфичность действия – определенный ген обеспечивает развитие не любого признака, а строго определенного.
-
Дозированность действия – ген обеспечивает развитие признака не до бесконечности, а в определенных пределах.
-
Дискретность – поскольку гены в хромосоме не перекрываются, то в принципе ген развивает признак независимо от других генов.
-
Стабильность – гены могут передаваться без каких-либо изменений в ряду поколений, т.е. ген не меняет свою структуру при передаче последующим поколениям.
-
Мобильность – при мутациях ген может менять свою структуру.
Функция гена, его проявление,заключается в образовании специфическогопризнака организма. Удаление гена илиего качественное изменение приводятсоответственно к потере или изменениюпризнака, контролируемого этим геном.
В то же время любой признак организмаявляется результатом взаимодействиягена с окружающей и внутренней,генотипической, средой. Один и тот жеген может принимать участие в формированиинескольких признаков организма (явлениетак наз. плейотропии).
Основная массапризнаков формируется как результатвзаимодействия многих генов (явлениеполигении). В то же время даже в пределахродственной группы особей, находящихсяв сходных условиях существования,проявление одного и того же гена можетварьировать по степени выраженности(экспрессивности, или экспрессии).
Этоуказывает на то, что при формированиипризнаков гены выступают как целостнаясистема, строго функционирующая вопределенной генотипической и окружающейсреде.
Виды генов.
-
Структурные гены – несут информацию о 1-ой структуре белка
-
Регуляторные гены – не несут информацию о 1-ой структуре белка, но регулируют процесс биосинтеза белка
-
Модификаторы – способны изменить направление синтеза белка
Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
Самым известным биомаркером в таргетной анти-EGFR терапии пациентов c мКРР является статус мутаций кодонов 12 и 13 гена KRAS. Доказано, что активация KRAS за счет мутации сводит на нет эффект ингибирования EGFR моноклональными антителами. Таким образом, наличие мутантных аллелей гена KRAS является независимым предсказательным маркером эффективности терапии ингибиторами EGFR. Поэтому панитумумаб и цетуксимаб назначают только больным мКРР с диким типом гена KRAS.
Влияние дополнительных мутаций гена KRAS и новых мутаций гена NRAS, а также мутаций гена BRAF на эффективность таргетной терапии ингибиторами EGFR изучалось в исследованиях с панитумумабом и цетуксимабом пациентов мКРР:
- Анализ мутаций генов KRAS/NRAS и мутации гена BRAF в исследовании 3 фазы PRIME: комбинации панитумумаб+FOLFOX4 в сравнении с FOLFOX4 в 1-й линии терапии метастатического колоректального ракаOliner K, Douillard JY, Siena S, et al. Analysis of KRAS/NRAS and BRAF mutations in the phase III PRIME study of panitumumab (pmab) plus FOLFOX versus FOLFOX as first-line treatment (tx) for metastatic colorectal cancer (mCRC). ASCO 2013 (poster discussion): 3511
- Анализ мутаций генов RAS/RAF в исследовании 2 фазы PEAK: комбинации панитумумаба с mFOLFOX6 в сравнении с бевацизумабом в комбинации с mFOLFOX6 в 1-й линии терапии пациентов с метастатическим колоректальным раком с WTKRASSchwartzberg LS, Rivera F, Karthaus M, et al. PEAK (study 20070509): A randomized phase II study of mFOLFOX6 with either panitumumab (pmab) or bevacizumab (bev) as first-line (tx) in patients (pts) with unresectable wild type (WT) KRAS metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 30 (Suppl 34): 446
- Анализ влияния мутаций генов семейства RAS (2 экзона KRAS и других RAS-мутаций) в исследовании CRYSTAL: комбинации цетукпсимаба с FOLFIRI в сравнении с FOLFIRI в 1-й линии терапии пациентов с метастатическим колоректальным раком на выживаемость пациентов без прогрессии и общую выживаемостьVan Cutsem et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015 Mar 1; 33(7): 692-700
Все исследования показали, что, несмотря на то, что индивидуализация терапии антителами по статусу генов семейства RAS предусматривает сужение круга пациентов (примерно 50/50 вместо 60/40 при отборе только лишь по статусу 2 экзона гена KRAS), пациенты с диким типом генов KRAS и NRAS в опухоли получат максимальную пользу от терапии антителами в комбинации со стандартной химиотерапией, по сравнению с пациентами без мутаций гена KRAS во 2 экзоне. Пока нет достаточных доказательств негативного влияния мутаций генов BRAF, PI3K, PTEN и других участников сигнального пути RAS-RAF-MEK-ERK-МАРК по результатам крупных проспективных рандомизированных исследований, однако не исключено, что появление таких исследований вновь существенно изменит наши представления о группе пациентов, для которых применение анти-EGFR антител окажется наиболее выгодным.
В связи с этим целью программы является максимально широкое внедрение генетического тестирования при колоректальном раке в ежедневную практику онкологов, как одного из важнейших условий проведения современной эффективной терапии у целевой группы пациентов.
Список литературы:
- Heldin CH. Dimerization of cell surface receptors in signal transduction. Cell 1995; vol.80, no.2, pp.213-223.
- Carpenterand G, Cohen S. Epidermal growth factor. J Biol Chem, 1990; vol.265, no.14, pp.7709-7712.
- Citri A, Yarden Y. EGF-ERBB signalling: towards the systems level. Nature Rev Molecular Cell Biol 2006; vol.7, no.7, pp.505-516.
- Boguski MS, McCormick F. Proteins regulating Ras and its relatives. Nature 1993; 366: 643-654.
- Vakiani E, Solit DB. KRAS and BRAF: drug targets and predictive biomarkers. J Pathol 2011; 223: 219-229.
- Edkins S, O’Meara S, Parker A, et al. Recurrent KRAS codon 146 mutations in human colorectal cancer. Cancer Biol Ther 2006; 5: 928-932.
- Janakiraman M, Vakiani E, Zeng Z, et al. Genomic and biological characterization of exon 4 KRAS mutations in human cancer. Cancer Res 2010; 70: 5901-5911.
- Soh J, Okumura N, Lockwood WW, et al. Oncogene mutations, copy number gains and mutant allele specific imbalance (MASI) frequently occur together in tumor cells. PLoS One. 2009, 14, no.4(10). P.7464.
Войтив базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Регистрацияв программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Гетерозиготное определение
Гетерозиготный индивидуум является диплоид организм с двумя аллелями, каждый разного типа. Индивидуумы с аллелями одного типа известны как гомозиготные. аллель это вариация ген это влияет на функциональность белка, продуцируемого геном. Там может быть много аллелей в Население но гетерозиготный индивидуум может иметь только два из них, потому что каждый диплоидный организм получает один аллель от каждого родителя. Хотя каждый организм может иметь только два аллеля, в популяции может быть множество вариаций гена.
Гетерозиготный является описанием генотип или комбинация аллелей, присутствующих в организме. Генотип порождает фенотип, В зависимости от разных взаимоотношений между аллелями у гетерозиготного индивида создаются разные фенотипы. В аллелях, которые показывают полное доминирование гетерозиготный фенотип будет таким же, как и доминантный фенотип. Неполное доминирование напротив, производит гетерозиготный фенотип, который находится где-то между доминантным и рецессивным фенотипом. Третий тип отношений, кодоминантность, существует, когда разные аллели экспрессируются индивидуально в разных частях тела. При кодоминантном признаке гетерозиготные индивидуумы будут демонстрировать фенотип одного аллеля в некоторых частях своего тела и фенотип другого аллеля в разных частях тела.
Мутация гена протромбина G20210A
Мутация гена протромбина G20210A характеризуется заменой нуклеотида гуанина на нуклеотид аденин в позиции 20210. Мутация была открыта Лейденской группой исследования тромбофилии в 1996 г. Особенностью данной мутацией является то, что замена нуклеотида располагается в 3.-нетранслируемом участке (участке, располагающемся в конце ДНК-последовательности гена, который не транслируется). Это означает, что нуклеотидная последовательность измененного участка не участвует в кодировании аминокислотной последовательности гена протромбина. Поэтому никаких химических изменений самого протромбина при наличии данной мутации не возникает. При наличии данной мутации обнаруживаются повышенные количества химически нормального протромбина. Уровень протромбина может быть в полтора-два раза выше, чем в норме.
Ген протромбина располагается в одиннадцатой хромосоме. Гетерозиготными носителями геня являются 2-3% представителей европейской расы. Гомозиготный вариант мутации является очень редкой находкой. Среди африканцев и представителей монголоидной расы данная мутация встречается очень редко. Мутация наследуется по аутосомно-доминантному типу. Это означает, что тромбофилия возникает даже у гетерозиготного носителя измененного гена.
При возникновении тромбозов мутация G20210A часто встречается в сочетании с лейденской мутацией. Данная мутация является фактором риска всех осложнений, связанных с лейденской мутацией (невынашивание беременности, фето-плацентарная недостаточность, внутриутробная гибель плода, гестозы, задержка развития плода, отслойка плаценты).
ЦИР рекомендует
Тромбофилические состояния (антифосфолипидный синдром, гипергомоцистеинемия, мутации генов MTHFR, V фактора и протромбина) являются одной из важных причин невынашивания беременности и фето-плацентарной недостаточности. Вне беременности данные состояния могут быть причиной тромботических осложнений гормональных контрацептивов и хирургических операций. Мы рекомендуем проводить молекулярно-генетическое обследование в следующих случаях:
- при наличии в прошлом двух и более остановок развития плода на ранних сроках беременности;
- при наличии в прошлом тяжелых осложнений беременности (тяжелых форм позднего токсикоза, внутриутробной гибели плода, задержки развития плода);
- при наличии родственников с тромботическими осложнениями в возрасте до 50 лет (тромбозы глубоких вен, тромбоэмболия легочной артерии, инсульт, инфаркт миокарда, внезапная смерть);
- при нескольких неудачных попытках IVF;
- при обнаружении повышения уровня антифосфолипидных антител и/или повышения уровня гомоцистеина;
- при планировании гинекологических операций;
- при планировании гормональной контрацепции.
Что такое гомозиготный организм в биологии: определение, свойства
- Гомозиготными — называются такие организмы, в которых содержаться аллели, состоящие исключительно из регрессивных или доминантных генов. Хромосомы в гомозиготных организмах, имеют одинаковые аллели, символически обозначенные: АА, аа.
- Данный вид генов, кодирует однотипные признаки в гомозиготном организме. К примеру, окрас лепестков от определенного сорта цветка — получит все дальнейшее его потомство, с сохранением фенотипических явлений и генотипа данного растения.
Гомозиготные организмы обладают такими свойствами:
- В момент соединения подобных организмов, разделение потомства по определенному признаку не прослеживается.
- Формируют по выбранному гену, однотипные гаметы.
Различия
Что такое мутационная изменчивость
Определение
Изменчивость, образованная в результате изменений генотипа под влиянием факторов внешней или внутренней среды, называется мутационной.
Мутационная изменчивость вызвана воздействием на организм мутагенов, приводящие к специфическим изменениям, т.е. реорганизации репродуктивного строения клетки.
Мутационную теорию разработал в 1901-1903 гг. голландский ботаник Гуго Де Фриз. Сущность концепции заключалась в следующем:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут
- Мутации образуются случайно в качестве дискретных изменений признаков.
- Они передаются в последующие поколения, в чем заключается их отличие от ненаследственных изменений.
- Изменения бывают вредными и полезными, доминантными и рецессивными.
- Обнаружить их можно при исследовании значительного количества особей.
- Они носят спонтанный характер: склонность к ним имеет любой участок хромосомы.
- Сходные мутации могут образоваться повторно.
Генотипическая, т.е. наследственная изменчивость является основой для возникновения разнообразных индивидуальных отличий, включающих в себя:
- качественные различия, не взаимосвязанные друг с другом, а также количественные различия, которые образуют непрерывные ряды, где близко расположенные элементы минимально отличаются друг от друга;
- изменения конкретного признака (независимая изменчивость) или изменения ряда черт (коррелятивная изменчивость);
- изменения с приспособительным значением, т.е. адаптивные, и «безразличные» — неадаптивные, способные снизить жизнеспособность носителя.
Каждый тип наследственных мутаций представляет собой эволюционный процесс.
Примечание
В отдельном организме наследственные признаки определяются не только теми генами, которые за них ответственны, но и характером взаимодействия с другими генами, входящих в генотип. Также учитываются внешние условия, в которых находился организм в процессе своего развития.
Аутосомный рецессивный признак
Чтобы выразить аутосомную рецессивную черту необходимо наличие двух копий аномальной аллели. У определенных поколений процент гетерозиготных носителей является высоким по причине эффекта инициатора (то есть была начата группа несколькими людьми, из которых один был носителем) либо вследствие того, что носители обладают селективным преимуществом (к примеру, гетерозиготность в случае серповидно-клеточной болезни служит защитой от малярии).
В данном случае применимы такие правила наследования:
Когда у здоровых родителей был рожден больной ребенок, оба родителя являются гетерозиготными носителями и, в среднем, один из 4х их потомков будет болен, один из 2х гетерозиготный, а один из 4х– здоровым.
В среднем, половина детей больного человека, а также один гетерозиготный носитель подвержены заражению, в треть является гетерозиготными носителями.
Все дети двух больных родителей будут больны.
Женщины и мужчины в одинаковой степени подвержены риску заражения.
Гетерозиготные носители фенотипически нормальны, однако выступают проводниками черты. Когда черта порождена дефектом специфического белка (к примеру, энзимы), обычно гетерозиготный человек имеет ограниченное количество этого белка. Когда нарушение известно, с помощью генетических молекулярных приемов возможно проведение идентификации гетерозиготных носителей.
Родственники скорее прочих унаследуют такую же мутантную аллель, поэтому браки между близкими родственниками сильно увеличивают вероятность рождения больных детей. У пары брат-сестра или родитель-ребенок вероятность родить нездорового ребенка возрастает за счет наличия 50 процентов одинаковых генов.
Полиморфизм гена MTHFR
Описано две разновидности гена MTHFR. Наиболее изученной является вариант, в котором нуклеотид цитозин (C) в позиции 677, относящейся к 4-му экзону, заменен на тимидин (T), что приводит к замене аминокислотного остатка аланина на остаток валина в сайте связывания фолата. Такой полиморфизм MTHR обозначается как мутация C677T. У лиц, гомозиготных по данной мутации, отмечается термолабильность MTHFR и снижение активности фермента примерно до 35% от среднего значения. Кроме того, у лиц, гомозиготных по данной мутации, отмечается нарушенное распределение фолатов в эритроцитах, выражающееся в накоплении формильных полиглютаматов тетраглютамата и метилированных дериватов тетрагидрофолата. Наличие этой мутации сопровождается повышением уровня гомоцистеина в крови.
Другим вариантом полиморфизма гена MTHFR является замена нуклеотида аденина (A) на цитозин (C) в позиции 1298. Это приводит к замене остатка глутамина на остаток аланина в регуляторном домене фермента, что сопровождается небольшим снижением активности. У лиц, гомозиготных по мутации А1298C, отмечается снижение активности MTHFR примерно до 60% от нормы. Предполагается, что снижение активности фермента связано с изменением регуляции фермента его ингибитором S-аденозилметионином.
В отличие от полиморфизма C677T, гетерозиготность и гомозиготность по мутации А1298C не сопровождается ни повышением концентрации общего гомоцистеина, ни снижением уровня фолата в плазме. Однако комбинация гетерозиготности аллелей 677T и 1298C сопровождается не только снижением активности фермента, но и повышением концентрации гомоцистеина в плазме и снижением уровня фолата, как это бывает при гомозиготности 677T.
Диагностика гомо- и гетерозиготности по аллелям 677T и 1298C производится методом полимеразной цепной реакции (ПЦР).
Полиморфизм гена фактора V: лечится или нет
«Поправить» дефектный ген в молекуле ДНК невозможно, но гемостазиологи предлагают, как вариант, предупредить осложнения тромбофилии профилактическими мерами. Медикаментозная терапия при мутации Лейдена назначается, исходя из прогнозируемого по результатам анализа риска тромбозов:
- Гетерозиготная мутация (дефектный 1 из двух аллелей гена проакцелерина) имеет более благоприятный прогноз. В этом случае антикоагулянты назначаются только при беременности, перед планируемой операцией, при серьезных травмах и приеме ЗГТ. Риск тромбоза при гетерозиготной форме МLeiden повышен в 7 раз, при беременности – в 15 раз.
- Гомозиготная форма (повреждены оба аллеля) или комбинация Лейденской с мутацией гена F2, протеинов-антикоагулянтов С и S является показанием для перманентной, постоянной противотромботической терапии. У носителей гомозиготного полиморфизма F5 или мультигенной тромбофилии вероятность тромбоза в 20, 80, 100 раз выше (в зависимости от количества дефектных генов) по сравнению со здоровым человеком.
Обследование и сопровождение пациентов с мутацией Лейдена проводят в МЖЦ на Таганской – профильной клинике под руководством Татьяны Владимировны Кузнецовой, профессоров Александра Давидовича Макацария и Виктории Омаровны Бицадзе. На базе нашей Научной лаборатории патологии гемостаза вы сможете сдать анализ на мутацию в гене FV Leiden, который позволит определить риск тромбофилии и подобрать оптимальную противотромботическую терапию.