Блокаторы н2 гистаминовых рецепторов
Содержание:
- Механизм действия Н2-блокаторов и показания к применению
- Блокаторы Н3 гистаминовых рецепторов
- Тактика, препараты лечения аллергии гиперчувствительности немедленного типа.
- Описание
- Медицинское применение
- Классификация антигистаминов
- Гистаминовые рецепторы Н1, Н2, Н3, Н4
- Современные аналоги блокаторов
- Препараты и их краткая характеристика
- Антигистамины III поколения
- Н2-блокаторы в современной гастроэнтерологической практике. Индивидуальный подбор препаратов[править | править код]
- Антигистаминные препараты для детей
- См. также
Механизм действия Н2-блокаторов и показания к применению
На мембране внутри стенки желудка расположены гистаминовые (Н2) клеточные рецепторы. Это париетальные клетки, которые в организме причастны к выработке соляной кислоты.
Ее чрезмерная концентрация вызывает нарушения в функционировании пищеварительной системы и приводит к язве.
Вещества, которые содержатся в Н2-блокаторах
, имеют свойство снижать уровень выработки желудочного сока. Также они угнетают уже готовую кислоту, выработка которой спровоцирована потреблением пищи.
В связи с оказываемым действием, Н2-блокаторы назначают при таких состояниях:
- язва (как желудка, так и двенадцатиперстной кишки);
- стрессовая язва — вызванная тяжелыми соматическими заболеваниями;
- язва, возникшая на фоне длительного приема нестероидных противовоспалительных или кортикостероидных препаратов;
- острый панкреатит и обострение хронического;
- в сочетании с ферментными панкреатическими препаратами, с целью их защиты от разрушающего воздействия желудочного сока.
Дозировка и длительность приема Н2-антигистаминных лекарственных препаратов при каждом из перечисленных диагнозов назначается индивидуально.
Блокаторы Н3 гистаминовых рецепторов
Н3-рецепторы сначала были найдены на гистаминергических нейронах ЦНС в виде пресинаптических рецепторов, которые регулируют образование и высвобождение гистамина. Н3-рецепторы как мишень фармакологического воздействия, сегодня имеют меньшее значение. Гистаминсодержащие нейроны в основном локализуются в заднем гипоталамусе. Кроме угнетающего влияния на высвобождение гистамина, пресинаптические Н3-рецепторы участвуют в регуляции продукции других медиаторов / модуляторов (ацетилхолина, ГАМК, дофамина, глутамина, серотонина, норадреналина), таким образом, они функционируют и как гетерорецепторы. Кроме ЦНС, Н3-рецепторы есть в ЖКТ (их стимуляция подавляет секрецию кислоты хлористоводородной желудка, они участвуют в гастропротекторном действии), в сердечно-сосудистой системе (активация пресинаптических Н3-рецепторов подавляет адренергический влияние), в верхних дыхательных путях (противовоспалительный эффект). К блокаторам Н3-рецепторов относятся ципроксифан, клобенпропит, тиоперамид, клозапин.
Синонимы: антигистамины, антигистаминные лекарственные средства, антигистаминные препараты.
Тактика, препараты лечения аллергии гиперчувствительности немедленного типа.
Лечение
аллергических заболеваний следует
начинать с выяснения природы аллергена
(пыльца растений, медикамент, определенная
пища и др.). Устранение контакта с
аллергеном дает наилучший результат.
При
аллергии (гиперчувствительности)
немедленного типа применяют следующие
группы препаратов.
Понижающие
синтез гистамина:
а) глюкокортикоиды
(гидрокортизон, преднизолон, триамцинолон,
дексаметазон);
б) нестероидные
противовоспалительные средства
Препятствующие
освобождению гистамина и других БАВ из
тучных клеток и базофилов:
а) глюкокортикоиды
(гидрокортизон, преднизолон, триамцинолон,
дексаметазон);
б) повышающие
активность аденилатциклазы
— β–адреномиметики
(адреналин, изадрин, орципреналин,
салбутамол, фенотерол), гистаглобулин,
гистамин (малые дозы))
в) ингибиторы
фосфодиэстеразы:
— ксантины
(теофиллин, эуфиллин);
— производные
кромогликата: интал (кромолин-иатрий);
— пиперидина:
кетотифен
г) понижающие
активность гуанилатциклазы
-М-холиноблокаторы
(атропин, атровент)
д) с комбинированным
механизмом действия:
кромоглициевая
кислота (интал);
кетотифен
(задитен);
азеластин
(аллергодил);
лоратадин
(кларитин);
недокромил
натрия (тайлед);
фенспирид
(эреспал);
цитеризин(зиртек)
Увеличивающие
гистаминопексию:
глюкокортикоиды,
гепарин, гистаглобулин, препараты
кальция
Препятствующие
взаимодействию свободного гистамина
с тканевыми рецепторами:
1)
Блокаторы Н1 рецепторов:
а) этаноламины
: дифенгидрамин (димедрол), клемастин
(тавегил), лоредикс (сетастин), цетиризин
(зиртек), левоцетиризин (ксизал)
б) этиленамины:
хлоропирамин (супрастин);
в) фенотиазины:
прометаизин (дипразин);
г) хинуклидины:
хифенадин (фенкарол), бикафен;
д) тетрагидрокарболины:
мебгидролин (диазолин), димебон;
е) пиперидины:
кетотифен, ципрогептадин (перитол),
астемизол, терфенадин (бронал), лоратадин
(кларитин), бамипин (совентол), дезлоратадин
(эриус);
ж) пиперазины
: циннаризин, оксатамид (тимсет), меклозин
(бонин);
з) трипролидина
: акривастин (семпрекс);
другие
фармакологические группы : азеластин
(аллергодил), димебон, диметинден
(фенистил), левокабастин (гистмет),
траниласт, фенспирид (эреспал), эбастин
(кестин);
2) Блокаторы
Н2 рецепторов:
циметидин,
ранитидин, фамотидин, низатидин,
роксатидин
Средства,
уменьшающие повреждение тканей:
глюкокортикоиды.
Средства,
уменьшающие общие проявления аллергических
реакций:
а) адреномиметики;
б) бронхолитики
миотропного действия (эуфиллин);
в) глюкокортикоиды
Описание
Препараты этой группы ингибируют H+-K+-АТФазу (протонный насос) на апикальной мембране париетальных клеток слизистой оболочки желудка. Этот фермент осуществляет перенос ионов водорода из париетальной клетки в просвет желудка.
Высокая селективность ингибиторов протонного насоса обусловлена тем, что их активация возможна только при кислом значении pH (<4). После активации они образуют прочные ковалентные связи с сульфгидрильными группами 813-й аминокислоты (цистеин) H+-K+-АТФазы и тормозят заключительный этап секреции соляной кислоты. Подавление кислотопродукции этими препаратами не зависит от состояния рецепторов (Н2, м3 и др.) на базальной мембране париетальных клеток. Ингибирование протонного насоса омепразолом, лансопразолом, пантопразолом необратимо, рабепразолом — частично обратимо (его комплекс с Н+-К+-АТФазой может диссоциировать).
Ингибиторы протонного насоса дозозависимо подавляют секрецию соляной кислоты, как базальную (ночную и дневную), так и стимулированную (вне зависимости от вида стимула). Эффективно предупреждают усиление секреции после приема пищи. Отмена препарата не сопровождается феноменом рикошета, а кислотопродукция восстанавливается в течение нескольких дней (после синтеза новых молекул H+-K+-АТФазы).
Ингибиторы H+-K+-АТФазы обеспечивают достижение клинико-эндоскопической ремиссии при всех кислотозависимых заболеваниях, в т.ч. требующих пролонгированной или постоянной терапии. Они поддерживают значения рН в желудке в пределах, благоприятных для заживления язвы желудка или двенадцатиперстной кишки длительное время в течение суток. На фоне лечения отмечается быстрое улучшение самочувствия (исчезает болевой синдром и диспептические явления), нормализация морфофункционального состояния слизистой оболочки желудка, сокращение сроков рубцевания пептических язв. Применение при гастроэзофагеальной рефлюксной болезни способствует уменьшению времени экспозиции соляной кислоты в пищеводе, ослаблению повреждающих свойств содержимого желудка. Продолжительность угнетения внутрижелудочной секреции (рН более 4), достигающая 12 ч, обеспечивает возможность заживления эрозивного эзофагита в течение 8 нед.
Ингибиторы протонного насоса увеличивают концентрацию антибактериальных средств в слизистой оболочке желудка и, поддерживая более высокие значения рН, увеличивают активность ряда антибиотиков. Это создает оптимальные условия для проявления эффектов антибактериальных компонентов, входящих в схемы эрадикационной антихеликобактерной терапии (тройная или квадротерапия). Ингибиторы H+-K+-АТФазы обладают и собственным антихеликобактерным эффектом (in vivo подавляют рост Нelicobacter pylory, действуя на систему АТФазы бактерий). Включение ингибиторов H+-K+-АТФазы в комбинированную эрадикационную терапию рекомендуется при язвенной болезни желудка и двенадцатиперстной кишки, ассоциированных с Н. pylori в период обострения и ремиссии, кровоточащей пептической язве, хеликобактерном гастрите с выраженными изменениями слизистой оболочки желудка, мальтомах желудка низкой степени злокачественности, после эндоскопического удаления опухоли желудка. Ингибиторы H+-K+-АТФазы влияют на результаты диагностики инфекции Н. pylori биохимическими методами. Поэтому уреазные тесты для контроля полноты эрадикации Н. pylori могут проводиться не ранее чем через 4 нед после окончания приема.
Ингибиторы протонного насоса предупреждают повреждение слизистой оболочки желудка и двенадцатиперстной кишки НПВС, уменьшают частоту повторных желудочно-кишечных кровотечений (осложнение язвенной болезни), особенно если в процессе лечения была достигнута эрадикация Н. pylori. При хроническом панкреатите способствуют эффективному купированию болевого синдрома за счет подавления секреции и снижения интрапанкреатического давления. Применение ингибиторов протонного насоса может сопровождаться гипергастринемией и повышением уровня пепсиногена I в сыворотке (менее выражены после эрадикации Н. pylori). Через 2–3 нед после прекращения лечения уровень гастрина в сыворотке возвращается к исходному.
Ингибиторы H+-K+-АТФазы могут понижать моторно-эвакуаторную функцию желудка вследствие гипомотилинемии. При длительном применении следует учитывать возможность развития атрофии слизистой оболочки желудка, кампилобактерного гастроэнтерита, чрезмерного размножения и колонизации нехеликобактерных бактерий в слизистой оболочке желудка и тонкой кишки и нарушения динамического равновесия микрофлоры толстой кишки.
Медицинское применение
Как лекарственное средство гистамин имеет ограниченное применение.
Выпускается в виде дигидрохлорида (Histamini dihydrochloridum). Белый кристаллический порошок. Гигроскопичен. Легко растворим в воде, трудно в спирте; рН водных растворов 4,0—5,0.
Синонимы: Eramin, Ergamine, Histalgine, Histamyl, Histapon, Imadyl, Imido, Istal, Peremin и др.
Пользуются гистамином иногда при полиартритах, суставном и мышечном ревматизме: внутрикожное введение дигидрохлорида гистамина (0,1—0,5 мл 1 % раствора), втирание мази, содержащей гистамин, и электрофорез гистамина вызывают сильную гиперемию и уменьшение болезненности; при болях, связанных с поражением нервов; при радикулитах, плекситах и т. п. препарат вводят внутрикожно (0,2—0,3 мл 0,1 % раствора).
При аллергических заболеваниях, мигрени, бронхиальной астме, крапивнице иногда проводят курс лечения малыми, возрастающими дозами гистамина. Предполагают, что организм при этом приобретает устойчивость к гистамину, и этим уменьшается предрасположенность к аллергическим реакциям (применение в качестве десенсибилизирующего средства при аллергических заболеваниях имеет также содержащий гистамин препарат гистаглобулин).
Начинают с внутрикожного введении очень малых доз гистамина (0,1 мл в концентрации 1/10, для чего содержимое ампулы, то есть 0,1 % раствор, разводят соответствующим количеством изотонического раствора натрия хлорида), затем дозу постепенно увеличивают.
Гистамином пользуются также для фармакологической диагностики феохромоцитомы и феохромобластомы; проводят комбинированную пробу с тропафеном.
В связи со стимулирующим влиянием гистамина на желудочную секрецию, его иногда применяют для диагностики функционального состояния желудка (в некоторых вариантах или внутрижелудочной рН-метрии)
При этом необходимо соблюдать большую осторожность из-за возможных побочных явлений (гипотензивное действие, бронхиолоспазм и др.). В настоящее время для этой цели пользуются другими препаратами (пентагастрин, бетазол и др.)
При передозировке и повышенной чувствительности к гистамину могут развиться коллапс и шок.
При приёме внутрь гистамин трудно всасывается и эффекта не оказывает.
Гистамином широко пользуются фармакологи и физиологи для экспериментальных исследований.
Форма выпуска
Формы выпуска гистамина дигидрохлорида: порошок; 0,1 % раствор в ампулах по 1 мл (Solutio Histamini dihydrochloridi 0,1 % pro injectionibus) в упаковке по 10 ампул.
Классификация антигистаминов
Антигистаминные препараты, которые блокируют Н1-рецепторы (Н1-гистаминоблокаторы), тем самым устраняют или уменьшают такие виды действия гистамина (см. Гистамин), как повышение тонуса гладких мышц бронхов, кишечника, матки; снижение АД (частично) повышение проницаемости капилляров с развитием отека; зуд и гиперемию при интрадермальном введении гистамина или при появлении в коже эндогенных источников гистамина. Указанные эффекты вызваны в основном аллергическими реакциями немедленного типа, которые сопровождаются явлениями острой экссудации: аллергический ринит (см. Аллергия, Анафилаксия), крапивница, ангионевротический отек, укусы насекомых, аллергические реакции на лекарственные средства, аллергия на продукты питания, сывороточная болезнь, дерматозы пара (псевдо) аллергические реакции.
Сегодня на рынке присутствуют три поколения лекарственных препаратов: I, II, III группы антигистаминных средств.
Гистаминовые рецепторы Н1, Н2, Н3, Н4
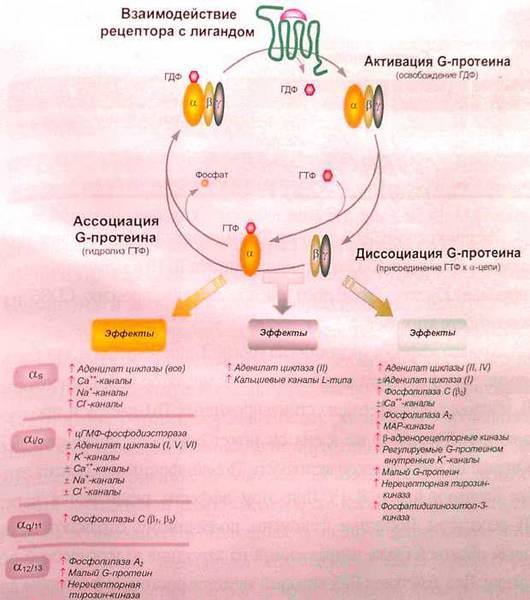 Циклическая активация и инактивация G-протеинов, связанных с клеточными гистаминовыми рецепторами, и разнообразие индуцированных ими биологических эффектов. В состоянии покоя тример αβγ связывает гуанозиндифосфат (ГДФ). Взаимодействие гистаминового рецептора с лигандом приводит к высвобождению ГДФ и активации G-протеина. Присоединение в дальнейшем к α-цепи гуанозинтрифосфата (ГТФ), присутствующего в клетке в избытке, ведет к диссоциации G-протеина на α-мономер и βγ-димер. В момент распада обе структуры способны инициировать спектр внутриклеточных биохимических эффектов, качественные особенности которых определяются главным образом типом α-цепи. Блокирование сигнала возникает под действием белков, получивших название RGS (regulators of G-protein signaling). Они связываются с α-цепью и резко ускоряют гидролиз ГТФ. Переход ГТФ в ГДФ вновь приводит к ассоциации цепей G-протеина.
Циклическая активация и инактивация G-протеинов, связанных с клеточными гистаминовыми рецепторами, и разнообразие индуцированных ими биологических эффектов. В состоянии покоя тример αβγ связывает гуанозиндифосфат (ГДФ). Взаимодействие гистаминового рецептора с лигандом приводит к высвобождению ГДФ и активации G-протеина. Присоединение в дальнейшем к α-цепи гуанозинтрифосфата (ГТФ), присутствующего в клетке в избытке, ведет к диссоциации G-протеина на α-мономер и βγ-димер. В момент распада обе структуры способны инициировать спектр внутриклеточных биохимических эффектов, качественные особенности которых определяются главным образом типом α-цепи. Блокирование сигнала возникает под действием белков, получивших название RGS (regulators of G-protein signaling). Они связываются с α-цепью и резко ускоряют гидролиз ГТФ. Переход ГТФ в ГДФ вновь приводит к ассоциации цепей G-протеина.
Спектр биологических эффектов гистамина достаточно широк, что обусловлено наличием не менее четырех типов гистаминовых рецепторов:
- Н1,
- Н2,
- Н3,
- Н4.
Они принадлежат самому распространенному в организме классу сенсоров, в который входят зрительные, обонятельные, хемотаксические, гормональные, нейротрансмиссионные и ряд других рецепторов. Разнообразие структур внутри класса у позвоночных может варьироваться от 1000 до 2000, а общее количество соответствующих генов обычно превышает 1% объема генома. Это складчатые белковые молекулы, 7-кратно «прошивающие» наружную клеточную мембрану и ассоциированные с G-протеином с внутренней ее стороны. G-протеины также представлены многочисленным семейством. Их объединяет общность структуры (состоят из трех субъединиц: α, β и γ) и способность связывать нуклеотид гуанин (отсюда название «guanine-binding proteins» или «G-proteins»).
Известно 20 вариантов цепей Gα, 6 — Gβ и 11 — Gγ. Во время проведения сигнала (смотрите рисунок выше) сцепленные в покое субъединицы G-протеина распадаются на мономер α и димер βγ. На основе различии в строении α-субъединиц G-протеины разделены на 4 группы (αs, αi, αq, α12). Каждая группа имеет свои особенности инициирования внутриклеточных сигнальных путей. Таким образом, в конкретном случае лиганд-рецепторного взаимодействия реакция клетки определяется как специфичностью и структурой самого гистаминового рецептора, так и свойствами ассоциированного с ним G-протеина.
Отмеченные особенности характерны и для гистаминовых рецепторов. Они кодируются индивидуальными генами, расположенными на разных хромосомах, и ассоциируются с различными G-npoтеинами (смотрите таблицу ниже). Кроме того, имеются существенные отличия по тканевой локализации отдельных типов Н-рецепторов. При аллергии большая часть эффектов реализуется через Н1-гистаминовые рецепторы. Наблюдаемые при этом активация G-протеина и высвобождение αq/11-цепи инициируют через фосфолипазу С расщепление мембранных фосфолипидов, образование инозитол трифосфата, стимуляцию протеинкиназы С и мобилизацию кальция, что сопровождается проявлением клеточной реактивности, иногда называемой «аллергия на гистамин» (например, в носу — ринорея, в легких — спазм бронхов, в коже — покраснение, образование крапивницы и волдыря). Другой сигнальный путь, идущий от Н1-гистаминового рецептора, может индуцировать активацию транскрипционного фактора NF-κВ, что обычно реализуется в формировании воспалительной реакции.
| Гистаминовый рецептор | G-протеин | Хромосома | Локализация |
|---|---|---|---|
| Н1 | αq | 3 | Гладкая мускулатура бронхов и кишечника, сосуды |
| Н2 | αs | 5 | Желудок |
| Н3 | α | 20 | Нервы |
| Н4 | α | 18 | Костномозговые клетки, эозинофилы |
Гистамин способен усиливать Тh2-иммунный ответ за счет подавления продукции IL-12 и активации синтеза IL-10 в антигенпрезентирующих клетках. Кроме того, он повышает экспрессию CD86 на поверхности этих клеток.
Однако эффекты гистамина на уровне Т-лимфоцитов могут быть иными (вплоть до противоположных). Так медиатор через гистаминовые рецепторы Н1 усиливает пролиферацию стимулированных Th1-клеток и продукцию IFN-γ. В то же время он может оказывать ингибирующее влияние на митотическую активность Тh2-лимфоцитов и синтез этими клетками IL-4 и IL-13. При этом эффекты реализуются через Н2-гистаминовые рецепторы. Последние феномены, по-видимому, отражают механизм обратной свази, направленный на затухание аллергической ре-акции. Под действием IL-3, который является ростовым фактором для мастоцитов и базофилов, также индуктором гистидиндекарбоксилазы, происходит усиление экспрессии Н1-гистаминовых рецепторов на лимфоцитах Th1 (но не Th2).
К.В. Шмагель и В.А. Черешнев
Современные аналоги блокаторов
На замену блокаторам приходят новые препараты – ингибиторы протонной помпы, но они не всегда могут использоваться в лечении в силу генетических или иных особенностей пациента или по экономическим соображениям. Одним из препятствий для применения ингибиторов является довольно часто встречающаяся резистентность (невосприимчивость к лекарству).

Н2-блокаторы отличаются от ингибиторов протонной помпы в худшую сторону тем, что их эффективность снижается при повторном курсе лечения. Поэтому длительная терапия предполагает использование ингибиторов, а для краткосрочного лечения вполне достаточно Н-2 блокаторов.
Принимать решение о выборе препаратов имеет право только врач на основании анамнеза больного и результатов исследований. Пациентам с язвой желудка или двенадцатиперстной кишки, особенно при хроническом течении болезни или при первом появлении симптомов, необходимо индивидуально подбирать кислотоподавляющие средства.
Препараты и их краткая характеристика
Циметидин (торговые названия – Гистодил, Циметидин)
Препарат I-го поколения. Обладает большим количеством побочных эффектов, из-за чего сегодня не применяется и практически отсутствует в фармсети. Ранее назначался внутрь в дозе 800-1000 мг в 4, 2 или 1 вечерний прием либо внутривенно по 300 мг 3 раза в сутки.
Ранитидин (Гистак, Зантак, Ранигаст, Ранисан, Ранитидин и прочие)
Препарат II поколения.
Ранитидин… От чего эти таблетки, знает любая бабушка. По моему опыту, это любимое средство от боли в желудке лиц за 70. Это потому, что во времена их молодости еще не было препаратов, которые более предпочтительны для лечения гастритов и язв желудка сейчас (речь об ингибиторах протонной помпы), а был именно он – ранитидин.
Как и циметидин, его можно применять внутрь или внутривенно. Для перорального приема используют таблетки по 150 или 300 мг. Суточная доза при этом составляет 300 мг, принимают препарат 1-2 раза в сутки. В вену вводят по 50 мг (2 мл) 3-4 раза в сутки.
Переносится ранитидин гораздо лучше, нежели циметидин, однако зарегистрированы случаи развития острого гепатита на фоне приема этого препарата.
Фамотидин (Квамател, Фамотидин)
Препарат III поколения. Согласно данным исследований, он в 7-20 раз эффективнее ранитидина. Действие его – продолжительное (после перорального приема фамотидин действует в течение 10-12 часов).
Как правило, хорошо переносится больными и при лечении обострений, и в случае профилактического приема. Побочных эффектов – минимум, среди них – незначительные симптомы со стороны пищеварительного тракта или же аллергические реакции, которые не требуют отмены препарата.
Может применяться у лиц с алкогольной зависимостью, не требует полного отказа от приема алкоголя в период лечения.
Выпускается в форме таблеток по 0.02 и 0.04 г, а также в ампулах, содержащих 0.01 г препарата в 1 мл.
Обычно принимают фамотидин в дозе 0.04 г в сутки за 1 (вечером) или 2 (утром и вечером) приема. Внутривенно вводят по 0.02 г дважды в день.
Антигистамины III поколения
Антигистамины III поколения являются активными метаболитами препаратов II поколения (фексофенадин — активный метаболит терфенадина, норастемизол — астемизола, дезлоратадин — лоратадина), обеспечивают повышенный уровень профиля безопасности. Они тормозят медиаторы системного аллергического воспаления, включая хемокины и цитокины, и уменьшают экспрессию молекул адгезии, подавляют хемотаксис, образование супероксидного радикала и активацию эозинофилов; снижают бронхиальную гиперреактивность. Применение антигистаминов III поколения наиболее рациональное при проведении длительном лечении аллергических болезней (сезонный аллергический ринит, круглогодичный аллергический ринит или риноконъюнктивит с продолжительностью обострений более 2 недель, хроническая крапивница, атопический и аллергический контактный дерматит).
Н2-блокаторы в современной гастроэнтерологической практике. Индивидуальный подбор препаратов[править | править код]
О месте Н2-блокаторов среди других противоязвенных препаратов см. «Место ингибиторов протонного насоса среди других противоязвенных препаратов».
Из-за побочных эффектов циметидин в настоящее время не применяется. Ранитидин, чья кислотоподавляющая способность немного проигрывает фамотидину (или хотя бы не превосходит), но обладает более широким спектром побочных эффектов, также уходит из лечебной практики (ранитидина висмута цитрат, используемый для антихеликобактерной терапии является исключением). Другие однокомпонентные Н2-блокаторы также не имеют заметных преимуществ перед фамотидином и, вынужденные, кроме того, конкурировать с ингибиторами протонного насоса, не получили широкого распространения в российском (а также мировом) здравоохранении. Поэтому сегодня в России из Н2-блокаторов, с точки зрения практической гастроэнтерологии, актуален только фамотидин.
«В общем» Н2-блокаторы проигрывают по целому ряду основных характеристик ингибиторам протонного насоса, не превосходя их по другим. Однако ИПП имеют ряд недостатков, среди которых: высокий процент пациентов, имеющих резистентность к тем или иным ИПП, возможность так называемого «ночного кислотного прорыва» и т. д. В силу этого у ряда пациентов фамотидин оказывается приемлемее ингибиторов протонного насоса.
Усреднённая суточная рН-грамма желудка после приёма Н2-блокаторов: 800 мг циметидина, 300 мг ранитидина и 40 мг фамотидина (по М. В. Леоновой и Ю. Б. Белоусову)
Поэтому больным с язвой желудка и язвой двенадцатиперстной кишки, особенно больным с впервые выявленной язвой и с хронической язвой, резистентной к проводимой терапии, часто необходим индивидуальный подбор кислотоподавляющих препаратов. Несмотря на доказанную эффективность ИПП — на купирование клинических симптомов в течение 1-3 дней от начала приема препарата существует индивидуальная чувствительность организма больного к секреторным препаратам, оценить которую можно только при проведении внутрижелудочной рН-метрии, на основании которой осуществляется выбор конкретного антисекреторного препарата — ингибитора протонного насоса или Н2-блокатора.
Антигистаминные препараты для детей
Для лечения аллергических проявлений у детей используют антигистаминные препараты всех трех поколений.
Антигистаминные средства 1 поколения отличаются тем, что быстро проявляют свое лечебное свойство и выводятся из организма. Они бывают востребованы для лечения острых проявлений аллергических реакций. Их назначают короткими курсами. Наиболее эффективным из этой группы считается Тавегил, Супрастин, Диазолин, Фенкарол.
Значительный процент побочных эффектов приводит к уменьшению применения этих лекарств при детской аллергии.
Антигистаминные препараты 2 поколения не вызывают седативного эффекта, действуют более продолжительное время и их применяют обычно раз в сутки. Мало побочных эффектов. Среди препаратов этой группы для лечения проявлений детской аллергии используют Кетотифен, Фенистил, Цетрин.
3 поколение антигистаминных препаратов для детей включает в себя Гисманал, Терфен и другие. Их используют при хронических аллергических процессах, поскольку они способны долгое время находиться в организме. Побочные эффекты отсутствуют.
К более новым препаратам можно отнести Эриус.
Негативные последствия:
-
1 поколение: головная боль, запор, тахикардия, сонливость, сухость во рту, нарушение зрения, задержка мочи и отсутствие аппетита;
-
2 поколение: негативное влияние на сердце и печень;
-
3 поколение: не имеют, рекомендуются к применению с 3-х лет.
Для детей выпускают антигистаминные препараты в форме мазей (аллергические реакции на коже), капель, сиропов и таблеток для приема внутрь.
См. также
- Категория:H1-антигистаминные средства
- Блокаторы H3-гистаминовых рецепторов
Аллерги́я (др.-греч. ἄλλος — другой, иной, чужой + ἔργον — воздействие) — типовой иммунопатологический процесс, выраженный сверхчувствительностью иммунной системы организма при повторных воздействиях аллергена на ранее сенсибилизированный этим аллергеном организм.
Симптомы: резь в глазах, отёки, насморк, крапивница, чихание, кашель и пр.
Антиконгестанты на основе фенилэфрина — комбинированные антиконгестанты, которые содержат адреномиметик фенилэфрин (мезатон), действующий как сосудосуживающее средство. В комбинации с ним используются, как правило, другие сосудосуживающие средства либо антигистаминные препараты (блокаторы H1-гистаминовых рецепторов), действующие как противоаллергические средства.
Они применяются как средства против насморка различного происхождения (ринит при простуде, аллергии, хронический ринит), при синуситах, отитах и в некоторых других случаях (например при подготовке к хирургическому вмешательству в области носа и для устранения послеоперационных отёков слизистой оболочки носа и придаточных пазух).
Ранее вместо фенилэфрина в подобных лекарствах использовался псевдоэфедрин, однако его продажа во многих странах была ограничена, так как он может служить прекурсором для изготовления в кустарных условиях наркотика метамфетамина. Для замены псевдоэфедрина в лекарственных средствах, отпускаемых без рецепта, фармацевтические компании стали использовать схожий с ним по фармакологическому действию фенилэфрин (мезатон).
Буторфанол — лекарственное средство, опиоидный анальгетик.
Гистамин, также имидазолил-2-этиламин — органическое соединение, биогенный амин, медиатор аллергических реакций немедленного типа, также является регулятором многих физиологических процессов.
И́стинная полицитеми́я (от др.-греч. πολυ- — «много» + гистологическое κύτος — «клетка» + αἷμα — кровь) (синонимы: первичная полицитемия, polycythemia vera, эритремия, erythremia, болезнь Вакеза) — доброкачественный опухолевый процесс системы крови, связанный с чрезмерной миелопролиферацией (гиперплазией клеточных элементов костного мозга). Этот процесс в большей степени затрагивает эритробластический росток. В крови появляется избыточное количество эритроцитов, но также увеличивается (в меньшей степени) количество тромбоцитов и нейтрофильных лейкоцитов. Клетки имеют нормальный морфологический вид. За счёт увеличения числа эритроцитов повышается вязкость крови, возрастает масса циркулирующей крови. Это ведёт к замедлению кровотока в сосудах и образованию тромбов, что приводит к нарушению кровоснабжения и гипоксии.
Заболевание впервые было описано Вакезом (Vaquez) в 1892 году. В 1903 году Ослер высказал предположение, что в основе болезни лежит повышенная активность костного мозга. Им же эритремия была выделена в отдельную нозологическую форму.
Истинная полицитемия — болезнь взрослых, чаще лиц пожилого возраста, но встречается и у молодых и детей. Долгие годы болезнь не даёт о себе знать, протекает без симптомов. По разным исследованиям, средний возраст заболевших колеблется от 60 до 70-79 лет. Молодые люди болеют реже, но болезнь у них протекает тяжелее. Мужчины болеют несколько чаще, чем женщины, соотношение приблизительно 1,5:1,0, среди больных молодого и среднего возраста преобладают женщины. Установлена семейная предрасположенность к этому заболеванию, что говорит о генетической предрасположенности. Среди хронических миелопролиферативных заболеваний истинная полицитемия встречается чаще всего. Распространенность составляет 29:100000.
Снотворные средства (от лат. hypnotica; син. гипнотические средства, уст.) — группа психоактивных лекарственных средств, используемых для облегчения наступления сна и обеспечения его достаточной продолжительности, а также при проведении анестезии.
В настоящее время классификация АТС не выделяет такой отдельной фармакологической группы.