Железо
Содержание:
- Экономическая геология
- Симптомы дефицита железа в организме
- История – краткая справка
- Минерал
- Классификация черных металлов
- Свойства железа и его соединений
- Железо: история
- Специальные сорта стали
- Применение сульфата железа при воронении стали
- Классы лома черного металла
- Как не допустить алиментарный железодефицит
- Что такое сывороточное железо и какова норма железа в крови? Для чего проводят анализ сывороточного железа?
- Получение железа (чугуна и стали)
- Дефицит железа
Экономическая геология
Железный рудник Халл-Ржавчина-Махонинг в железном хребте
Полосчатые железные пласты обеспечивают большую часть добываемой в настоящее время железной руды . Более 60% мировых запасов железа находится в виде полосчатых железных пластов, большая часть которых находится в Австралии, Бразилии, Канаде, Индии, России, Южной Африке, Украине и США.
Различные горнодобывающие районы придумали свои названия для BIF. Термин «ленточная образование железа» была введена в железных районах озеро Верхнее , где рудные отложения Mesabi, Маркетты , Кайюо, Gogebic и меномините диапазоны железы также по- разному известный как «яшма», «jaspilite», «железа -носящая формация », или таконит . Пластинчатые железные образования были описаны как «итабарит» в Бразилии, как «железный камень» в Южной Африке и как «BHQ» (полосчатый гематитовый кварцит) в Индии.
Полосчатая формация железа была впервые обнаружена в северном Мичигане в 1844 году, и разработка этих месторождений подтолкнула к самым ранним исследованиям BIF, таким как исследования Чарльза Р. Ван Хайза и Чарльза Кеннета Лейта . Операции по добыче железа на хребтах Месаби и Куюна превратились в огромные открытые карьеры , где паровые экскаваторы и другие промышленные машины могли извлекать огромное количество руды. Первоначально на рудниках разрабатывались большие пласты гематита и гетита, выветриваемые из полосчатых железных пластов, и к 1980 году было извлечено около 2,5 миллиардов тонн этой «природной руды». К 1956 году крупномасштабная промышленная добыча из самого БИФ началась на Петерском Шахта Митчелл близ Бэббита, Миннесота . В 2016 году производство в Миннесоте составило 40 миллионов тонн рудного концентрата в год, что составляет около 75% от общего объема добычи в США. Богатое магнетитом пластовое железо, известное как таконит, измельчают до порошка, а магнетит отделяют с помощью мощных магнитов и гранулируют для транспортировки и плавки.
Шахта Тома Прайса, хребет Хамерсли , Австралия
Железная руда стала глобальным товаром после Второй мировой войны , а с окончанием эмбарго на экспорт железной руды из Австралии в 1960 году хребет Хамерсли стал крупным горнодобывающим районом. Полосчатые железные образования здесь самые толстые и обширные в мире, первоначально занимая площадь в 150 000 квадратных километров (58 000 квадратных миль) и содержащих около 300 триллионов метрических тонн железа. Диапазон содержит 80 процентов всех выявленных запасов железной руды в Австралии. Ежегодно с полигона удаляется более 100 миллионов метрических тонн железной руды.
Полосчатые железные образования итабарита в Бразилии покрывают не менее 80 000 квадратных километров (31 000 квадратных миль) и имеют толщину до 600 метров (2000 футов). Они образуют Quadrilatero Ferrifero или Железный четырехугольник , который напоминает рудники Iron Range в Соединенных Штатах тем, что предпочтительной рудой является гематит, выветренный из BIF. Производство железного четырехугольника помогает Бразилии стать вторым по величине производителем железной руды после Австралии, с ежемесячным экспортом в среднем 139 299 метрических тонн с декабря 2007 года по май 2018 года.

Кыдашанский открытый чугунный рудник, один из трех крупных карьеров, окружающих город Аншань
Добыча руды из полосчатых железных пластов в Аньшане на севере Китая началась в 1918 году. Когда Япония оккупировала Северо-Восточный Китай в 1931 году, эти заводы были превращены в японскую монополию, и город стал важным стратегическим промышленным центром во время Второй мировой войны. Общее производство обработанного железа в Маньчжурии достигло 1 000 000 метрических тонн в 1931–1932 годах. К 1942 году общая производственная мощность Anshan’s Shōwa Steel Works достигла 3 600 000 метрических тонн в год, что сделало его одним из крупнейших металлургических предприятий в мире. Производство было серьезно нарушено во время советской оккупации Маньчжурии в 1945 году и последующей гражданской войны в Китае . Однако с 1948 по 2001 год металлургический завод произвел 290 миллионов тонн стали, 284 миллиона тонн чугуна и 192 миллиона тонн проката . Годовая производственная мощность по состоянию на 2006 год составляет 10 млн тонн чугуна, 10 млн тонн стали и 9,5 млн тонн стального проката. Четверть общих запасов железной руды Китая, около 10 миллиардов тонн, находится в Аньшане.
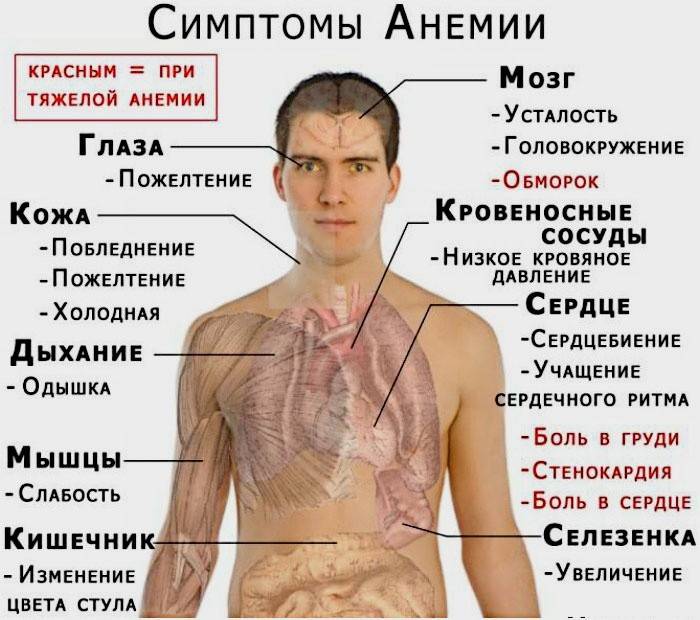
Симптомы дефицита железа в организме
скрытыеженщины – 8,9 мкмоль/л, мужчины – 11,6 мкмоль/лСимптомами латентной стадии дефицита железа в крови являются:
- снижение работоспособности;
- повышенная утомляемость;
- выраженное недомогание, слабость;
- учащенное сердцебиение (тахикардия);
- повышенная раздражительность;
- депрессии;
- головные боли и головокружение;
- затрудненное глотание;
- глоссит (воспалительный процесс языка);
- выпадение волос;
- ломкость ногтей;
- бледность кожных покровов;
- ухудшение памяти, внимания, мыслительных процессов, способности обучения;
- частые инфекции дыхательных путей;
- бессонница.
Симптомами выраженного дефицита железа являются:
- снижение иммунитета – пациент часто болеет вирусными и респираторными заболеваниями;
- пониженная температура тела, зябкость – температура тела ниже 36.6°С, человек некомфортно себя чувствует при низких температурах, у него постоянно холодные конечности;
- ухудшение памяти, внимания, темпов обучения – при дефиците железа пациенту трудно сосредоточиться, запомнить информацию, наблюдается частая забывчивость;
- снижение работоспособности – пациент постоянно чувствует себя усталым, «разбитым», даже после полноценного сна;
- нарушение работы желудочно-кишечного тракта – ухудшение аппетита, затруднение глотания, боли в области желудка, запор, метеоризм (избыточное скопление газов в просвете кишечника), появление отрыжки и изжоги;
- повышенная утомляемость, слабость в мышцах – пациент наблюдает у себя повышенную усталость даже после непродолжительной активности, также отмечает у себя слабость в мышцах при физических нагрузках и в покое;
- неврологические нарушения – повышенная раздражительность, вспыльчивость, депрессивные состояния, плаксивость, мигрирующие боли (головные, в области сердца);
- задержка умственного и физического развития у детей – недостаток железа приводит к кислородному голоданию, что негативно влияет на центральную нервную систему ребенка, развитие сердечно-сосудистой системы и других;
- геофагия (извращение питания) – при дефиците железа человек может начать употреблять в пищу несъедобные предметы – мел, землю, песок;
- сухость, бледность кожных покровов и слизистых оболочек – кожа становится сухой, начинает шелушиться, появляются трещины и выраженные морщины, образуются ранки в уголках рта (хейлит), стоматит (воспаление слизистого эпителия ротовой полости);
- сухость, ломкость ногтей и волос – при недостатке железа волосы становятся тусклыми, ломкими, теряют блеск и объем, ногти слоятся и легко ломаются;
- головокружение, потеря сознания (обмороки) – в результате снижения уровня гемоглобина в крови организм страдает от кислородного голодания, особенно это сказывается на головном мозге, что проявляется головокружением, кратковременной потерей сознания, потемнением в глазах;
- одышка, учащенное сердцебиение – дефицит железа приводит к недостатку кислорода, который организм пытается компенсировать путем учащения дыхания и сердцебиения.
История – краткая справка
Теорий происхождения слова «железо» несколько, которые во многом зависят от региона и наречия.
Русское наименование, к которому мы все привыкли имеет праславянские корни «želězo», которое в свою очередь видимо произошло из греческого «χαλκός», что в переводе означает «железо и медь».
Но как бы там не было, неоспоримый факт один – применение железа осуществлялось еще в 4 тысячелетии до н.э., т.к. именно этого периода были найдены древние изделия из этого материала.
Популярными историческими изделиями являются украшения из египетских гробниц (более 3000 до н.э.) и кинжал из древнего города Ур (Шумер), откуда согласно Священным Писанием Бог призвал выйти Авраама.
Первый народ, которые начали плавить Fe – хатты, которые проживали на территории Юго-Восточной сегодняшней Турции примерно в 2000 до н.э. Эти сведения археологи получили из древних текстов царя хеттов Анитты, завоевавшего со своим народом хаттов.
Первые сведения о получении из железа стали появились в записях Аристотеля, из легенды об аргонавтах. Народ «Халибы» тщательно промывали речной песок, отсеивая из него тяжелые фракции гематита и магнетита, которые затем в печи переплавляли до получения серебристого нержавеющего металла.
Минерал
Самородное железо (феррит) Fe относится к группе самородных элементов. Название происходит от латинского названия железа — «феррум».
Феррит содержит менее 2,9% Ni, до 0,3 % Co, до 0,4 % Cu, до 0,1 % Pt.
Сингония кубическая; в природе существует несколько модификаций железа — низкотемпературная имеет ОЦК ячейку (Im3m), высокотемпературная (при температурах > 1179K) ГЦК ячейку (Fm(-3)m).
Образует мелкие зёрна, плёнки, дендриты, изредка в виде самородков. В больших количествах содержится в метеоритах. Цвет железа стально-серый, в полированных шлифах
металлически-белый.Черта блестящая стально-серая. Блеск в свежем изломе типичный металлический. Твёрдость 4-5. Спайность по кубу {100}, излом крючковатый. Плотность 7-7,8. Характерный признак — сильномагнитный минерал.
В железных метеоритах при травлении или нагреве проявляются видманштеттеновы фигуры.
Происхождение: теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (втч и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
Семейство самородного железа (по Годовикову)
Группа самородного железа
- < 2,9, редко до 6,4 ат. % Ni — феррит
- < ~ 6,4 ат. % Ni — камасит
никеля
- > 24 ат. % Ni — тэнит
- 62,5 — 92 ат. % Ni — аваруит Ni3Fe
- (Ni, Fe) — Самородный никель
- Годовиков А.А., «Минералогия»,M.:»Недра», 1983 г.
Классификация черных металлов
В большинстве случаев, классификация черных металлов построена на основании разделения элементов по их химическому составу и свойствам. Содержание легирующих элементов определяет железо и его сплав. В свою очередь, определенное процентное содержание углерода в сплаве указывает что это — чугун или сталь. Так чугуны содержат более 1,7% углерода, а стали от 0,2 до 1,7% углерода. Классификация черных металлов подразумевает разделение на следующие классы:
- железные металлы;
- тугоплавкие;
- урановые;
- щелочноземельные;
- редкоземельные.
Также классификация черных металлов подразумевает отделение сталей легированных и нелегированных, которые еще называют углеродистыми. К углеродистым сталям относятся стали, в которых углерод является основным компонентом, при этом примеси на свойства металла не оказывают особого значения. Легированные имеют в наличие один или несколько легируемых элементов, которые оказывают огромное влияние на свойства стали. /Легированные стали очень широко применяется для изготовления ответственных деталей, несущих большую нагрузку, испытывающих разный температурный режим, сильное фрикционное воздействие. Применение такой стали распространенно в машиностроении, тракторостроении, тяжелой промышленности и в других областях.
Свойства железа и его соединений
Железо — химический элемент восьмой группы, четвёртого периода, следовательно, строение его атома можно изобразить схемой:
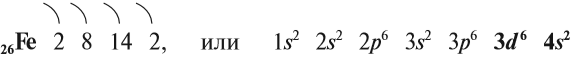
Железо — очень распространённый элемент периодической системы. Среди химических элементов, которые входят в состав Земной коры, оно занимает четвёртое место. В центре Земли имеется массивное железно-никелевое ядро, которое обеспечивает естественный магнетизм Земли.
Хотя атом железа в соединениях может проявлять степени окисления +2, +3, +6, в природе встречаются соединения преимущественно трёхвалентного железа:
- Fe2O3 — гематит (красный железняк);
- Fe2O3 · FeO — магнитный железняк;
- Fe2O3 · Н2О — бурый железняк.
Все эти руды имеют буро-красную окраску. Интересно, что от этой окраски произошло слово руда: «рудый» означает «рыжий». Дело в том, что железные руды встретились человеку давным-давно, и с освоения этих руд началась наша цивилизация, поскольку для разработки технологии выплавки железа из руды потребовались значительные интеллектуальные усилия, все знания, которых накопил человек.
Атомы железа (II) входят в состав гемоглобина крови. Именно эти атомы связывают кислород и транспортируют его по всем клеткам нашего организма. При этом атом железа становится трёхвалентным, с характерной для этого состояния «кровавой» окраской. Кстати, название руды «гематит» и означает «кровавый».
Железо — серебристо-белый пластичный металл. Это металл средней активности, тем не менее оно может реагировать с активными неметаллами (галогены, кислород, сера, углерод), кислотами, а при особых условиях — с водой. При этом если реакция происходит с сильным окислителем, то образуется соединение трёхвалентного железа. Впрочем, если в результате реакции образуется соединение двухвалентного железа, то на воздухе это соединение быстро окисляется до трёхвалентного состояния. Например, с сильным окислителем хлором образуется хлорид Fe (III):
А при взаимодействии с соляной кислотой, атом хлора которой может проявлять только восстановительные свойства, образуется хлорид железа (II).
Задание 11.1. Составить уравнение реакции взаимодействия железа с серой, водой, соляной кислотой, разбавленной азотной кислотой.
Соли железа (II) и (III) имеют разную окраску: растворы соединений железа (II) бесцветные, а растворы железа (III) — окрашены в жёлтый цвет.
При взаимодействии с щелочами из растворов солей железа можно получить его гидроксиды. Они так сильно отличаются друг от друга по цвету, что эту реакцию можно считать качественной на соединения железа с разной степенью окисления. Так, из солей Fe (II) выделяется белый (в инертной атмосфере) осадок, который на воздухе мгновенно зеленеет:
На воздухе этот осадок «ржавеет», становится буро-оранжевым. Состав полученного осадка очень близок к составу ржавчины:
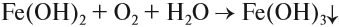
Наиболее чувствительной качественной реакцией на Fe3+ является реакция с роданидом калия:
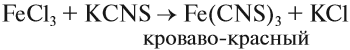
Оксид и гидроксид железа (II) проявляют основные свойства, т. е. реагируют с кислотами, но не реагируют со щелочами. В отличие от них, оксид и гидроксид железа (III) проявляют слабые амфотерные свойства. Это означает, что при обычных условиях эти вещества реагируют с кислотами и не реагируют со щелочами, но при сплавлении они со щелочами реагируют:
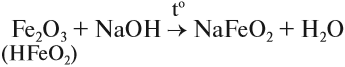
Кроме того, они растворяются в горячих, концентрированных растворах щелочей.
Таким образом, на примере свойств соединений железа ещё раз убеждаемся в справедливости закономерности: при возрастании степени окисления атома металла усиливаются и кислотные, и окислительные свойства соединений.
Действительно, для соединений двухвалентного железа характерны восстановительные свойства: они окисляются просто на воздухе. Для соединений трёхвалентного железа характерны окислительные свойства, они могут находиться в растворе длительное время. Единственное, что «угрожает» солям трёхвалентного железа, — гидролиз, поскольку эти соли соответствуют более слабому основанию.
Задание 11.2. Составьте уравнение реакции гидролиза хлорида железа (III).

Железо: история
Первые железные изделия, изготовленные человеком, датированы учёными IV тыс. до н. э., причем исследования показали, что для их производства использовалось метеоритное железо, для которого характерно 5-30-процентное содержание никеля. Интересно, но пока человечество не освоило добычу Fe путём его переплавки, железо ценилось дороже золота. Объяснялось это тем, что более крепкая и надежная сталь куда больше подходила для изготовления орудий труда и оружия, нежели медь и бронза.

Первый чугун научились получать древние римляне: их печи могли повышать температуру руды до 1400оС, в то время как чугуну было достаточно 1100-1200оС. Впоследствии они же получили и чистую сталь, температура плавления которой, как известно, составляет 1535 градуса по Цельсию.
Специальные сорта стали
Рассматривая, что такое металлолом, необходимо уделить внимание еще одной, обособленной категории стальных отходов. Это лом нержавейки и быстрорезов
Отходы нержавеющей стали принимаются исходя из содержания никеля в металле. Например, нержавейка с вхождениями Ni на уровне 8% оценивается в 42 000 рублей за тонну. Повышение концентрации до 18% увеличивает стоимость к величине 70 тысяч.
Наибольшей популярностью среди отходов инструментальной стали (быстрорезов), пользуются отечественные сорта Р6М5, Р18, а также импортная марка – HSS. По сути, это та же легированная сталь, где основными примесями выступают тугоплавкие металлы: вольфрам, молибден, ванадий и рений.
Применение сульфата железа при воронении стали
Воронение стали – это технологический процесс получения на поверхности стали оксидной пленки, которая не только защищает сталь, но и придает ей красивый вид. Процесс воронения производят в кислотных или же щелочных растворах, в состав которых входит сульфат железа.
Желая получить пленку голубоватого оттенка, применяют такой раствор:
- сульфат железа – 30 килограмм;
- соляная кислота – 30 килограмм;
- азотно-кислая ртуть – 30 килограмм;
- спирт этиловый – 120 килограмм.
Раствор нагревают до 20°С и обрабатывают в нем стальное изделие в течение двадцати минут.
При необходимости получить темно-красный оттенок воронения используют следующий раствор:
- сульфат железа – 3 килограмма;
- этиловый спирт – 3 килограмма;
- вода – 100 килограмм;
- азотно-кислая медь – 1,2 килограмма.
Раствор нагревают до 25°С и мягкой кистью смачивают поверхность стального изделия, дают высохнуть и смачивают снова. Процесс повторяют несколько раз до получения желаемого оттенка красного цвета.
Для закрепления на поверхности образовавшейся защитной пленки затем обрабатывают одним их 2-х методов.
- Метод 1. Длительно промывают в поточной воде, а затем пять минут кипятят в растворе из трех килограммов мыла на сто литров воды.
- Метод 2. Длительно промывают в горячей воде, а затем на 2 минуты погружают в нагретый до 70°С раствор бихромата натрия (12 килограмм на сто литров воды).
На заключительном этапе воронения стальное изделие высушивают, а затем тщательно смазывают каким-либо видом машинного масла.
Классы лома черного металла
С позиций упомянутого стандарта выделяют два класса черного лома. Основанием деления является доля содержания углерода в металле:
- стальные лом и отходы (содержат менее 2,14% углерода, что справедливо по отношению к железоуглеродистым сплавам с низким процентом примесей);
- чугунные отходы и лом (характеризуются высоким содержанием углерода в железе).
Иногда к этим классам добавляют и третий — нержавеющую сталь. Но ее позиция в классификации не может быть решена однозначно. С одной стороны, нержавейка – результат взаимодействия железа и углерода (чем является также конструкционная сталь и чугун), а с другой стороны, при ее производстве добавляют легирующие элементы – примеси (преимущественно цветных металлов), которые существенно изменяют свойства стали.
Как не допустить алиментарный железодефицит
- Консервированные моллюски: в 85 граммах содержится 26 миллиграммов (мг) железа
- Обогащенная, простая, сухая овсяная крупа: в 100 г содержится 24,72 мг железа
- Белая фасоль: в одном стакане содержится 21,09 мг железа
- Темный шоколад (от 45 до 69 процентов какао): в одном батончике содержится 12,99 мг железа
- Вареные тихоокеанские устрицы: в 85 граммах содержится 7,82 мг железа.
- Вареный шпинат: в одном стакане содержится 6,43 мг железа
- Говяжья печень: в 85 граммах содержится 4,17 мг железа
- Вареная и обсушенная чечевица: в половине стакана содержится 3,3 мг железа.
- Твердый тофу: в половине стакана содержится 2,03 мг железа
- Приготовленный сухой нут: в половине стакана содержится 2,37 мг железа.
- Консервированные, тушеные помидоры: в половине стакана содержится 1,7 мг железа
- Постный говяжий фарш: в 85 граммах содержится 2,07 мг железа
- Средне запеченный картофель: содержится 1,87 мг железа
- Жареные орехи кешью: в 85 граммах содержится 2 мг железа.
Что такое сывороточное железо и какова норма железа в крови? Для чего проводят анализ сывороточного железа?
60%эритроциты, тромбоциты, лейкоциты, лимфоциты и другиежировтромбаПоказаниями к анализу концентрации сывороточного железа являются:
- диагностика, дифференциальная диагностика (отличие одной патологии от другой со сходными симптомами) и контроль лечения анемий (патологического состояния, характеризующегося низким содержанием гемоглобина в эритроцитах);
- диагностика гемохроматоза (наследственного заболевания, характеризующегося нарушением обмена железа);
- диагностика интоксикации (отравления) железом;
- неполноценное питание, гиповитаминозы (недостаток витаминов);
- различные заболевания желудочно-кишечного тракта, при которых нарушается нормальное всасывание железа;
- выявленные отклонения в результатах общего анализа крови (эритроцитов, гематокрита);
- кровотечения различной этиологии (обильные длительные менструации, кровоточивость десен, кровотечение из геморроидальных узлов, язвы желудка или двенадцатиперстной кишки и других).
Анализ на сывороточное железо проводят для:
- оценки запасов железа в организме;
- расчета процента насыщения трансферрина железом (то есть определения концентрации железа, переносимого кровью);
- дифференциальной диагностики анемий;
- контроля лечения анемии;
- контроля лечения препаратами железа;
- диагностика генетических заболеваний нарушения обмена железа.
Норма железа в крови, в зависимости от возраста и пола
| Возраст | Пол | Норма железа |
| женский | 5,1 – 22,6 мкмоль/л | |
| мужской | 5,6 – 19,9 мкмоль/л | |
| от 1 до 12 месяцев | женский | 4,6 – 22,5 мкмоль/л |
| мужской | 4,9 – 19,6 мкмоль/л | |
| от 1 до 4 лет | женский | 4,6 – 18,2 мкмоль/л |
| мужской | 5,1 – 16,2 мкмоль/л | |
| от 4 до 7 лет | женский | 5,0 – 16,8 мкмоль/л |
| мужской | 4,6 – 20,5 мкмоль/л | |
| от 7 до 10 лет | женский | 5,5 – 18,7 мкмоль/л |
| мужской | 4,9 – 17,3 мкмоль/л | |
| от 10 до 13 лет | женский | 5,8 – 18,7 мкмоль/л |
| мужской | 5,0 – 20,0 мкмоль/л | |
| от 13 до 16 лет | женский | 5,5 – 19,5 мкмоль/л |
| мужской | 4,8 – 19,8 мкмоль/л | |
| от 16 до 18 лет | женский | 5,8 – 18,3 мкмоль/л |
| мужской | 4,9 – 24,8 мкмоль/л | |
| > 18 лет | женский | 8,9 – 30,4 мкмоль/л |
| мужской | 11,6 – 30,4 мкмоль/л |
Лекарственными препаратами, повышающими уровень железа в крови, являются:
- ацетилсалициловая кислота (аспирин) – нестероидное противовоспалительное средство;
- метотрексат – противоопухолевое средство;
- мультивитамины, содержащие железо;
- оральные контрацептивы – противозачаточные таблетки;
- антибиотики – метициллин, хлорамфеникол, цефотаксим;
- препараты, содержащие эстрогены (женские половые гормоны).
Лекарственными препаратами, понижающими уровень железа в крови, являются:
- ацетилсалициловая кислота в больших дозах – нестероидное противовоспалительное средство;
- аллопуринол – препарат, понижающий уровень мочевой кислоты в крови;
- кортизол – глюкокортикоидный гормон;
- метформин – таблетированное гипогликемическое средство (понижающее уровень сахара в крови);
- кортикотропин – препарат адренокортикотропного гормона;
- холестирамин – гиполипидемическое средство (снижающее уровень жиров в крови);
- аспарагиназа – противоопухолевое средство;
- препараты, содержащие тестостерон – мужской половой гормон.
Как правильно подготовиться к сдаче анализа на сывороточное железо?
Для правильной подготовки к диагностике уровня железа в крови необходимо:
- за неделю до сдачи анализа на сывороточное железо отменить прием лекарств и комплексов железосодержащих витаминов;
- перенести анализ сывороточного железа на несколько дней после гемотрансфузии (переливания крови);
- объяснить пациенту, что для анализа сывороточного железа необходимо будет взять пробу крови, объяснить суть процедуры, предупредить о неприятных ощущениях при наложении жгута и пункции (прокалывании) вены;
- описать режим дня и питания, который пациент должен соблюдать.
Общими требованиями к проведению анализа крови на сывороточное железо является:
- взятие исследуемой крови натощак;
- исключение курения, приема алкоголя и жирной пищи, физической активности за 12 часов до анализа;
- взятие исследуемого материала до проведения любых диагностических процедур (рентгенографии, компьютерной томографии);
- отсутствие у пациента вирусных и воспалительных заболеваний.
Получение железа (чугуна и стали)
Производство чугуна основано на восстановительных свойствах углерода. Чугун образуется в домнах, куда загружают смесь кокса и железной руды. В результате горения кокса образуется необходимое для реакции тепло и сильный восстановитель — угарный газ:
Впрочем, и кокс является прекрасным восстановителем:
Угарный газ является основным восстановителем доменного процесса, поскольку ввиду газообразного состояния имеет высокую реакционную способность, способен проникать в любую точку домны. Кроме того, он не образует цементита. Эти реакции восстановления происходят при температуре 450…700 °C:
Полученный углекислый газ, реагируя с избытком кокса, вновь превращается в угарный газ:
и процесс продолжается. Он происходит в верхней части домны. Выделяющееся в твёрдом виде железо опускается в нижнюю часть домны, контактирует с коксом, начинает плавиться, так как температура в этой части печи превышает 1300 °C. Кокс, образуя сплав с железом (чугун), понижает температуру плавления железа на 400°; одновременно с этим часть железа образует цементит:
Для предохранения расплавленного железа от окисления в исходную смесь добавляют флюсы. Это известняк, который является поставщиком углекислого газа и, всплывая на поверхность, образует защитную плёнку.
Полученный чугун содержит до 4,5 % углерода, он используется для получения стали. Цель переработки — удаление примесей углерода, фосфора, серы. Готовая сталь должна содержать 0,3…2 % углерода. Кроме того, в сталь вводят различные добавки, которые изменяют её свойства. Так, нержавеющая сталь содержит около 12 % хрома.
Сталь является основным сплавом машиностроения, но легко ржавеет, так как подвергается коррозии (см. урок 8.4).
Дефицит железа
Человек, у которого не хватает железа в организме, тут же ощущает это неблагоприятное явление. Первый признак – быстрая утомляемость и упадок сил.
Симптомы дефицита железа
- Малейшие физические нагрузки тут же вызывают учащенное сердцебиение и одышку – сказывается плохая транспортировка кислорода к клеткам.
- Головокружение, «мушки» в глазах.
- Обмороки.
- Онемение пальцев ног и рук.
- Ухудшение памяти и концентрации внимания.
- Частые инфекционные заболевания, простуды.
- Выпадение волос.
- Деформация, истончение и ломка ногтей.
- Бледность, «прозрачность» кожных покровов.
- Синяки под глазами и т. д.
Последствия дефицита железа
- Развивается глоссит – воспаляются сосочки языка с одновременной их атрофией.
- Хейлит – трещины в уголках губ, пародонтоз, возникает кариес.
- Гастрит (атрофический) – дисфагия, атрофия слизистой пищевода, оболочки носа.
- Изменение цвета склеры – она становится выражено голубой, из-за нехватки железа возникает дистрофия роговицы. Сплетения сосудов глаза практически незаметны.
- Гипотония мышечной структуры по всему телу. По этой причине возможны частые позывы к мочеиспусканию, недержание при кашле, чихании, смехе.
- Мышечные боли.
Симптомы дефицита железа в организме. Фото: zen.yandex.ru
Явным показателем железодефицита также являются язвочки, заеды в уголках рта, трещины на руках. У человека снижается аппетит, ему трудно глотать. Возникают странные желания, которые нередко путают с извращенным пищевым поведением – хочется скушать мел, облизывать железные предметы, съесть бумагу, песок, тесто и т. д.
Признаки дефицита железа у детей
Опасен дефицит железа в организме и для детей. Именно это явление зачастую приводит к умственной и физической отсталости. Также исследовано негативное влияние железа на рост ребенка и развитость его телосложения. Вызывает сбой в работе иммунитета из-за чего плохо проявляются защитные функции.
- Ребенок часто болеет инфекционными, грибковыми патологиями, частые простуды.
- Портится зрение, слух.
- Из-за проблем с памятью и концентрации внимания отстает от сверстников.
- Отличается худощавым и вялым телосложением, плохо кушает.
- Тошнота, рвота, понос.
- Частые истерики, плаксивость без причин, малоподвижность.
- Сонливость днем и бессонница по ночам.
У ребенка при дефиците железа в организме проявляются те же симптомы, что и у взрослых. И, если родители заметили хоть что-нибудь из перечисленного, или у малыша извратился вкус и он ест мел, бумагу и т.д. – налицо проблемы.
Признаки дефицита у беременных
У будущей матери недостаток железа – это частое явление
По этой причине важно вовремя проходить обследование и сдавать анализы. Дело в том, что организм беременной нуждается в большем количестве важного элемента – примерно на 15-20%
Дефицит способствует сбою клеточного дыхания, нарушению обменных процессов.
В результате, нехватка железа в организме проявляется симптомами:
- сонливость;
- вялость;
- деформация ногтевой ложи;
- бессонница по ночам;
- головные боли и головокружение;
- шум в ушах;
- одышка;
- обмороки;
- потеря аппетита;
- выпадение волос и т.д.
Самое опасное – недостаток снабжения плаценты кислородом, транспортировка которого обеспечивается в том числе и железом.
Последствия дефицита у беременных
- отслойкой плаценты;
- задержкой развития младенца;
- гестозом;
- преждевременными родами;
- железодефицитной анемией у малыша в первые месяцы жизни.
Анемия может вызывать экземы, тахикардию, сбой артериального давления (скачки), дрожь конечностей.
Что делать при дефиците железа
В первую очередь важно вовремя обратиться к врачу и пройти полное обследование организма. Ведь недостаток железа в организме может вызывать симптомы опасных заболеваний и процессов в организме человека
По результатам исследований анализов, врач назначает лечение для устранения первопричины. В случае, если проблема вызвана неправильным питанием и образом жизни, происходит коррекция рациона, графика и восполнение дефицита лекарственными препаратами.