Микробиом человека. pro et contra: хорошие бактерии против злых
Содержание:
- Геном
- Биологические свойства
- Как действуют бактерии, вызывающие кариес?
- Особенности лечения болезни
- История
- Внешнее строение
- К каким докторам следует обращаться если у Вас Bacillus cereus у детей:
- Описание
- Физико-химические свойства
- Описание
- Действие на вредные организмы
- Стоит ли стремиться к балансу?
- Лабораторное исследование
- Симптомы Bacillus cereus у детей:
- Online-консультации врачей
- Кожа под микроскопом
- Выводы
Геном
B. subtilis насчитывает около 4100 генов. Из них только 192 оказались незаменимыми; еще 79 были предсказаны как необходимые. Подавляющее большинство основных генов было отнесено к относительно небольшому количеству областей клеточного метаболизма, примерно половина из которых участвовала в обработке информации, одна пятая участвовала в синтезе клеточной оболочки и определении формы и деления клетки, а одна десятая была связана с клеткой. энергетика.
Полная последовательность генома штамма B. subtilis QB928 включает 4 146839 пар оснований ДНК и 4292 гена. Штамм QB928 широко используется в генетических исследованиях из-за наличия различных маркеров .
Несколько некодирующих РНК были охарактеризованы в геноме B. subtilis в 2009 году, включая Bsr РНК . Сравнительный геномный анализ на основе микрочипов показал, что представители B. subtilis демонстрируют значительное геномное разнообразие.
FsrA — это небольшая РНК, обнаруженная в Bacillus subtilis . Он является эффектором реакции сохранения железа и действует, подавляя железосодержащие белки в периоды низкой биодоступности железа.
Биологические свойства
Клетки B. cereus, окраска жгутиков по Лейфсону
Бациллы являются аэробами или факультативными анаэробами, большинство представителей хемоорганогетеротрофы и растёт на простых питательных средах. Некоторые виды способны к нитратредукции. Крупные и среднего размера прямые или слабо изогнутые палочки, способные к образованию устойчивых к неблагоприятным воздействиям эндоспор (экстремальным температурам, высушиванию, ионизирующим излучениям, химическим агентам), большинство видов подвижно и обладают жгутиками расположенными перитрихиально, Bacillus anthracis образует капсулы. По методу Грама окрашиваются положительно. Недавние исследования выявили, что бактерии вида Bacillus subtilis способны к каннибализму во время споруляции путём продукции токсинов в окружающую среду и дальнейшему лизису клеток своего вида.
Как действуют бактерии, вызывающие кариес?
Самые опасные с точки зрения развития кариеса зубов бактерии — разновидность стрептококка Str. mutans и молочнокислые Lactobacilli.
В основе патогенного действия этих бактерий лежат некоторые особенности:
- Str. mutans способны переносить сахара за счет особой транспортной системы.
- Они вырабатывают полисахариды, которые способствуют формированию налета на зубах.
- Эти патогенные бактерии превращают сахара в кислоты, разъедающие твердые ткани зубов.
- Они устойчивы к кислой среде и продолжают перерабатывать сахара при разных уровнях pH.
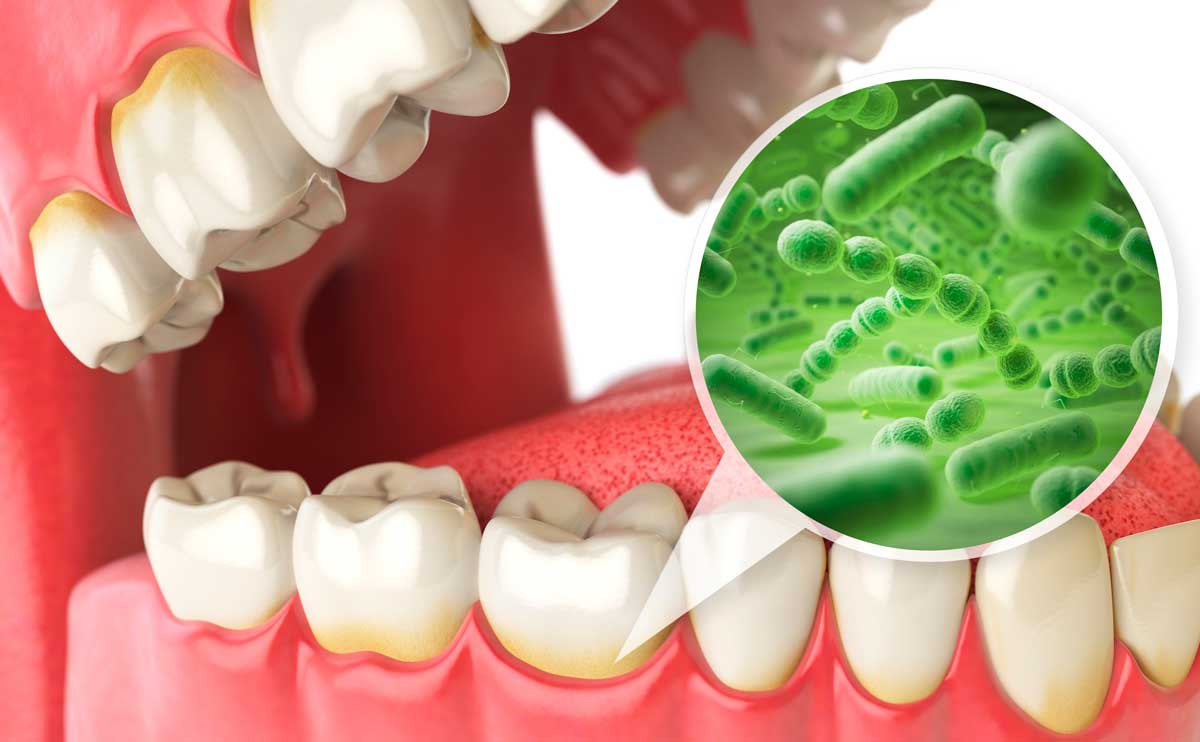
Научными исследованиями доказано, что при наличии кариеса стрептококки вида мутанс присутствуют в зубном налете гораздо чаще, чем у здоровых людей. Также кариесогенное поражение зубов вызывает бактерия лактобацилла, которая, наряду со стрептококком, способна вырабатывать кислоту. Однако в зубном налете пациента на этапе доклинического развития кариеса, как показали исследования, лактобацилл меньше, чем Str. mutans. Интересно, что после формирования кариозной полости в ней, напротив, присутствует больше лактобацилл. То есть стрептококки мутанс являются главными разрушителями зубов на этапе формирования зубных отложений и утраты зубной эмалью минеральных веществ. А лактобациллы — основные производители кислоты, разрушающей зуб, на этапе сформированной кариозной полости.
Сегодня выделяют еще один вид бактерий, которые могут способствовать развитию кариозного процесса. Это актиномицеты. Они вырабатывают гораздо меньше кислоты по сравнению с другими, поэтому их роль в развитии кариеса не столь значительна. Но при этом некоторые виды актиномицетов — в частности Actinomyces viscosus — могут способствовать развитию корневого кариеса.
Ученые отмечают, что любые бактерии в полости рта — это лишь один фактор, который вызывает кариес. Он играет значимую роль в развитии кариозной болезни при наличии других факторов риска.
Особенности лечения болезни
Назначение лечения коккобациллярной флоры невозможно без определения причин, спровоцировавших её развитие. Как уже было отмечено, нередко повышение уровня кокков и бацилл выступает признаком развития дисбактериоза в организме. Коррекция состояния в данном случае может быть достигнута изменениями ежедневного рациона.
Так, питание рекомендуется разнообразить кисломолочными продуктами и приёмами витаминных комплексов. Если же диагностирована тяжелая форма дисбактериоза, может понадобиться лечение пробиотиками, предназначенными для быстрого восстановления природной микрофлоры.
Выявление патологического нарушения может свидетельствовать и о наличии инфекционных заболеваний, передающихся половым путем. Пациенткам с таким диагнозом, как правило, назначают лечение противомикробными лекарственными средствами, антибиотиками и иммуномодуляторами, необходимыми для восстановления ослабленной иммунной системы.
Лечение диагностированных заболеваний, передающихся половым путем, предполагает прохождение назначенной терапии обеими партнерами. Лечение требуется даже в тех случаях, если пациента ничего не беспокоит. Дело в том, что даже без ярко выраженной симптоматики ЗППП могут стать причиной бесплодия и не менее серьёзных осложнений.
Специалисты в назначении схемы подавления коккобациллярной флоры отдают предпочтение комплексному подходу, предполагающему одновременное применение таблетированных препаратов с лекарственными средствами местного использования.
В большинстве случаев пациентам назначают лечение Метронидазолом – препаратом, противодействующим простейшим микроорганизмам и анаэробной флоре. Не меньшую эффективность приписывают и Орнидазолу, и Тенонитрозолу.
Что касается препаратов местного применения, то наиболее популярным в данной категории считается Гиналкин – таблетированное лекарственное средство, отличающееся широким спектром воздействия и предназначенное для введения во влагалище. Согласно многочисленным отзывам, нормализация состояния наблюдается после прохождения двухнедельного курса лечения.
История
В 1970 году американский исследователь Dulmage описал высоковирулентную культуру Bacillus Thuringiensis var. alesti (по современной классификации, subspecies kurstaki) штамм HD-1 (серотип Н3a3b), выделенную из гусениц хлопковой моли (Pectinophora gossypiella Saund.), погибших в лаборатории во время естественной эпиозотии. По данным Dulmage препарат, приготовленный на основе бацилл штамма HD-1 по биологической активности был в 20 раз эффективнее в борьбе против хлопковой моли и некоторых видов совок, чем коммерческие бактериальные препараты, выпускавшиеся тогда промышленностью.
В 1976 году на основе партии Z-2 был осуществлен промышленный выпуск опытной партии нового инсектицидного препарата, названного лепидоцидом. Позднее методом индуцированной селекции с последующим стабилизирующим отбором был получен штамм Z-52, превосходящий исходный штамм Z-2 по основным биологическим показателям, в частности отличающийся более высокой (в 4 с лишним раза) патогенностью для чешуекрылых насекомых вредителей, менее продолжительным периодом роста и т.п. На основе штамм Z-52 с 1983 года начат промышленный выпуск высокоэффективного препарата лепидоцида, нашедшее широкое применение в сельском и лесном хозяйстве.
Внешнее строение
Клетка бактерии одета особой плотной оболочкой – клеточной стенкой, которая выполняет защитную и опорную функции, а также придаёт бактерии постоянную, характерную для неё форму. Клеточная стенка бактерии напоминает оболочку растительной клетки. Она проницаема: через неё питательные вещества свободно проходят в клетку, а продукты обмена веществ выходят в окружающую среду. Часто поверх клеточной стенки у бактерий вырабатывается дополнительный защитный слой слизи – капсула. Толщина капсулы может во много раз превышать диаметр самой клетки, но может быть и очень небольшой. Капсула – не обязательная часть клетки, она образуется в зависимости от условий, в которые попадают бактерии. Она предохраняет бактерию от высыхания.
На поверхности некоторых бактерий имеются длинные жгутики (один, два или много) или короткие тонкие ворсинки. Длина жгутиков может во много раз превышать разметы тела бактерии. С помощью жгутиков и ворсинок бактерии передвигаются.
Внутреннее строение
Внутри клетки бактерии находится густая неподвижная цитоплазма. Она имеет слоистое строение, вакуолей нет, поэтому различные белки (ферменты) и запасные питательные вещества размещаются в самом веществе цитоплазмы. Клетки бактерий не имеют ядра. В центральной части их клетки сконцентрировано вещество, несущее наследственную информации. Бактерии, — нуклеиновая кислота – ДНК. Но это вещество не оформлено в ядро.
Внутренняя организация бактериальной клетки сложна и имеет свои специфические особенности. Цитоплазма отделяется от клеточной стенки цитоплазматической мембраной. В цитоплазме различают основное вещество, или матрикс, рибосомы и небольшое количество мембранных структур, выполняющих самые различные функции (аналоги митохондрий, эндоплазматической сети, аппарата Гольджи). В цитоплазме клеток бактерий часто содержатся гранулы различной формы и размеров. Гранулы могут состоять из соединений, которые служат источником энергии и углерода. В бактериальной клетке встречаются и капельки жира.
В центральной части клетки локализовано ядерное вещество – ДНК, не отграниченная от цитоплазмы мембраной. Это аналог ядра – нуклеоид. Нуклеоид не обладает мембраной, ядрышком и набором хромосом.
К каким докторам следует обращаться если у Вас Bacillus cereus у детей:
Инфекционист
Гастроэнтеролог
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Bacillus cereus у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Описание
Bacillus subtilis — это грамположительные палочковидные и каталазоположительные бактерии . Первоначально он был назван Vibrio Сенного по христианскому Готфриду Эренбергу и переименован Сенная палочки по Фердинанду Кона в 1872 году (Сенных будучи латинским «штраф»). Клетки B. subtilis обычно имеют палочковидную форму, около 4–10 микрометров (мкм) в длину и 0,25–1,0 мкм в диаметре, с объемом клеток около 4,6 мкл в стационарной фазе. Как и другие представители рода Bacillus , он может образовывать эндоспоры , чтобы выжить в экстремальных условиях окружающей среды с температурой и высыханием. B. subtilis является факультативным анаэробом и считался облигатным аэробом до 1998 года. B. subtilis сильно жгутиконосит , что дает ему способность быстро перемещаться в жидкостях.
B. subtilis оказался в высшей степени поддающимся генетическим манипуляциям и получил широкое распространение в качестве модельного организма для лабораторных исследований, особенно споруляции , которая является упрощенным примером клеточной дифференциации . С точки зрения популярности в качестве лабораторной модели организма B. subtilis часто рассматривается как грамположительный эквивалент Escherichia coli , широко изученной грамотрицательной бактерии.
Физико-химические свойства
Bacillus subtilis – наиболее продуктивные представители рода Bacillus по синтезу антибиотиков. Как правило, штаммы Bacillus subtilis образуют на питательной среде выпуклые колонии ризоидной формы. Хорошо растут на МПА, пептонно-кукурузном агаре и других средах. Размер клеток 0,7..0,8х2..3мкм. В почве бациллы находятся в виде спор или вегетативных клеток. При температурах почвы, близких к 0°C, большая часть бацилл образует споры; в этом состоянии микроорганизмы отличаются высокой устойчивостью к внешним факторам.
При наступлении благоприятных условий бактерии переходят в активное (вегетативное) состояние и начинают работать – защищать почву и растения от болезней. Чем выше рН (щелочные почвы), тем больше процент спор Bacillus subtilis.
Описание
CD14 и Mac-1 работают вместе, увеличивая интернализацию макрофагами спор B. anthracis . (а) CD14 и TLR2 работают в непосредственной близости для распространения сигнала активации. Mac-1 начинается с закрытого подтверждения, которое не позволяет интегрину связывать споры, не давая им попасть в клетку. (b) CD14 связывает остатки рамнозы на BclA экзоспория, что приводит к TLR2-опосредованной активации PI3K. (c) Активация PI3K подталкивает Mac-1 к его открытой конформации, так что спора может быть связана и интернализована (информация от Oliva et al. 2009)
B. anthracis представляют собой палочковидные бактерии длиной примерно от 3 до 5 мкм и шириной от 1 до 1,2 мкм. При выращивании в культуре они, как правило, образуют длинные цепочки бактерий. На чашках с агаром они образуют большие колонии в несколько миллиметров в диаметре, обычно белого или кремового цвета. Большинство штаммов B. anthracis образуют капсулу, которая придает колониям вид слизистой слизи.
Это одна из немногих бактерий, которые, как известно, синтезируют слабоиммуногенные и антифагоцитарные белковые капсулы (поли-D-гамма-глутаминовая кислота), которые скрывают вегетативные бактерии от иммунной системы хозяина. Большинство бактерий окружено полисахаридной капсулой, а не поли-gD-глутаминовой кислотой, что обеспечивает эволюционное преимущество B. anthracis . Полисахариды связаны с адгезией дефенсинов , секретируемых нейтрофилами, которые неактивны и разрушают бактерии. Не удерживая эту макромолекулу в капсуле, B. anthracis может избежать нейтрофильной атаки и продолжить распространение инфекции. Разница в составе капсул также значительна, потому что была выдвинута гипотеза, что поли-gD-глутаминовая кислота создает отрицательный заряд, который защищает вегетативную фазу бактерий от фагоцитоза макрофагами . Капсула разлагается до более низкой молекулярной массы и высвобождается с поверхности бактериальной клетки, чтобы действовать как приманка для защиты бактерий от .
Как и Bordetella pertussis , он вместе с летальным фактором сибирской язвы образует кальмодулин- зависимый экзотоксин аденилатциклазы, известный как фактор отека сибирской язвы . Он имеет близкое генотипическое и фенотипическое сходство с Bacillus cereus и Bacillus thuringiensis . Все три вида имеют общие клеточные размеры и морфологию . Все образуют овальные споры, расположенные в центре не набухшего спорангия . В частности, эндоспоры B. anthracis обладают высокой устойчивостью, выдерживают экстремальные температуры, среду с низким содержанием питательных веществ и жесткую химическую обработку в течение десятилетий или столетий.
Эндоспора — это обезвоженная клетка с толстыми стенками и дополнительными слоями, которые образуются внутри клеточной мембраны. Он может оставаться бездействующим в течение многих лет, но если попадает в благоприятную среду, он снова начинает расти. Изначально он развивается внутри стержневой формы. Такие особенности, как расположение внутри стержня, размер и форма эндоспоры, а также то, вызывает ли это выпячивание стенки стержня или нет, характерны для определенных видов Bacillus . В зависимости от вида эндоспоры бывают круглыми, овальными или иногда цилиндрическими. Они обладают высокой рефракцией и содержат дипиколиновую кислоту . Электронно-микроскопические снимки показывают, что они имеют тонкую внешнюю оболочку эндоспор, толстую кору спор и внутреннюю мембрану спор, окружающую содержимое эндоспор. Эндоспоры устойчивы к нагреванию, сушке и многим дезинфицирующим средствам (включая 95% этанол). Благодаря этим свойствам эндоспоры B. anthracis чрезвычайно хорошо подходят для использования (в порошкообразной и аэрозольной форме) в качестве биологического оружия . Такое размещение оружия осуществлялось в прошлом по крайней мере пятью государственными программами создания биологического оружия — в Соединенном Королевстве , Японии , США , России и Ираке — и было предпринято несколькими другими.
Действие на вредные организмы
Препараты на основе Bacillus thuringiensis, var. kurstaki обладают кишечным действием, эффективность которого проявляется только при попадании в кишечник насекомого при его активном питании. Специфичность действия на гусениц чешуекрылых связана со своеобразием их пищеварительной системы, которая имеет комбинацию рН, содержание солей и ферментов, необходимую для разложения и активации токсина бактерии.
Механизм действия. Активированный в кишечном тракте токсин вызывает повреждение внутренней оболочки кишечника гусеницы, в результате чего нарушается осмотическое равновесие, приводящее к просачиванию щелочного содержимого кишечника в тело гусеницы. Это просачивание может привести к гибели насекомого или вызвать у него такие изменения, которые создают условия для развития спор, содержащихся в препарате, или развитие постоянно присутствующей в насекомом кишечной микрофлоры, в результате чего проявляется септицемия.
Гибель гусеницы в зависимости от дозы препарата может наступать не сразу (1-4 дня), однако повреждения, нанесенные кишечному тракту, нарушают способность гусеницы переваривать пищу и вызывают приостановку питания и тем самым снижается поврежденность защищаемой культуры.
Наиболее высокая эффективность проявляется против открыто питающихся личинок младших возрастов при температуре воздуха 18-30°С. Массовая гибель насекомых наступает на 2-5-е сутки. У препаратов на основе Bacillus thuringiensis, var. kurstaki наблюдается воздействие и на последующие поколения насекомых – вредителей растений: в популяциях появляются уродливые куколки, а появившиеся из них бабочки дают неспособное к продлению рода потомство, меняется также соотношение полов, снижается плодовитость самок. Препараты на основе Bacillus thuringiensis, var. kurstaki сохраняют свою активность на обработанных растений в течение 8-10 дней.
Стоит ли стремиться к балансу?
Способность кожи противостоять инфекциям и болезням является очень сложным многофакторным процессом.
Это комбинация большого количества систем, которые должны работать в синергизме (Grice et al. 2008; Cogen et al. 2009). К ним относятся физический барьер, поверхностный рН хозяина и «активный синтез» генетически кодируемых молекул в его организме.
Неграмотно проводить различия между «полезными» и «вредными» микроорганизмами. Можно только опираться на способность самой кожи противостоять болезням и инфекциям, а не пытаться объяснять это «сложным внутренним миром» самих микробов, навешивая на них субъективные ярлыки «отрицательных» или «положительных» героев.
Кроме того, нельзя забывать о связи кожи с иммунной системой.
Микробы на коже могут влиять на поведение иммунных клеток. Недавние испытания показали, что Staphylococcus epidermidis помогает иммунной системе контролировать инфекции, изменяя функцию Т-клеток (ключевой компонент адаптивного иммунного ответа организма) для повышения иммунитета хозяина.
Исследования обнаружили, что различные микробы сообща влияют на составляющие иммунной системы, и то, как они общаются с иммунной системой, очень специфично для каждого микроба (Wallen-Russell et al. 2017).
Многие из кожных микроорганизмов являются безвредными и в некоторых случаях обеспечивают жизненно важные функции, которые человеческий геном не развил. Симбиотические микроорганизмы занимают широкий спектр кожных ниш и защищают от вторжения более патогенных или вредных организмов. Эти микроорганизмы могут также влиять на миллиарды Т-клеток, которые с их помощью учатся противостоять патогенам.
И вся эта система должна находиться в тонком балансе не только между собой, но еще и «дружить» с организмом-хозяином.
Американцы показали, что разнообразие микробов – это гарантия стабильности и равновесия в организме (Wallen-Russell et al. 2017).
Вывод: чем разнообразнее микробиом, тем лучше здоровье.
Лабораторное исследование
Компоненты чая , такие как полифенолы , обладают способностью значительно подавлять активность как B. anthracis, так и его токсина; споры, однако, не затрагиваются. Добавление молока в чай полностью подавляет его антибактериальную активность против сибирской язвы. Активность против B. anthracis в лаборатории не доказывает, что употребление чая влияет на течение инфекции, поскольку неизвестно, как эти полифенолы абсорбируются и распределяются в организме. B. anthracis можно культивировать на агаре PLET, селективной и дифференциальной среде, специально разработанной для селекции B. anthracis .
Недавние исследования
Достижения в методах генотипирования привели к улучшению генетического анализа вариабельности и родства. Эти методы включают анализ тандемных повторов с переменным числом множественных локусов ( MLVA ) и системы типирования с использованием канонических однонуклеотидных полиморфизмов . Хромосома предка Эймса была секвенирована в 2003 году и способствует идентификации генов, участвующих в вирулентности B. anthracis . Недавно изолят B. anthracis H9401 был выделен от корейского пациента, страдающего желудочно-кишечной сибирской язвой. Цель Республики Корея — использовать этот штамм в качестве контрольного штамма для разработки рекомбинантной вакцины против сибирской язвы.
Штамм H9401, выделенный в Республике Корея, был секвенирован с использованием технологии GS-FLX и проанализирован с использованием нескольких инструментов биоинформатики для выравнивания, аннотирования и сравнения H9401 с другими штаммами B. anthracis . Уровень охвата секвенированием предполагает молекулярное соотношение pXO1: pXO2: хромосома как 3: 2: 1, что идентично штаммам Ames Florida и Ames Ancestor. H9401 имеет 99,679% гомологии последовательности с Ames Ancestor с гомологией аминокислотной последовательности 99,870%. H9401 имеет кольцевую хромосому (5218947 п.н. с 5480 предсказанными ORF ), плазмиду pXO1 (181 700 п.н. с 202 предсказанными ORF) и плазмиду pXO2 (94 824 п.н. с 110 предсказанными ORF). По сравнению с указанной выше хромосомой Ames Ancestor, хромосома H9401 примерно на 8,5 kb меньше. Из-за высокой патогенности и сходства последовательностей с предком Эймса, H9401 будет использоваться в качестве эталона для тестирования эффективности вакцин-кандидатов против сибирской язвы в Республике Корея.
Поскольку геном B. anthracis был секвенирован, предпринимаются попытки найти альтернативные способы борьбы с этим заболеванием. Бактерии разработали несколько стратегий, позволяющих избежать распознавания иммунной системой. Преобладающий механизм предотвращения обнаружения, используемый всеми бактериями, — это молекулярный камуфляж. Незначительные модификации внешнего слоя, которые делают бактерии практически невидимыми для лизоцимов. Были идентифицированы и охарактеризованы три из этих модификаций. К ним относятся (1) N-гликозилирование N-ацетилмурамовой кислоты, (2) O-ацетилирование N-ацетилмурамовой кислоты и (3) N-деацетилирование N-ацетил-глюкозамина. Исследования последних нескольких лет были сосредоточены на предотвращении таких модификаций. В результате исследуется ферментативный механизм полисахариддеацетилаз, которые катализируют удаление ацетильной группы из N-ацетилглюкозамина и N-ацетилмурамовой кислоты, компонентов пептидогликанового слоя.
Симптомы Bacillus cereus у детей:
Инфекционный процесс, к которому приводят рассматриваемые бактерии, может проявляться разными симптомами. Пищевое отравление «выливается» острым гастроэнтеритом. При иных путях заражения наблюдается развитие менингита, бронхопневмонии, остеомиелита, абсцесса мозга, панофтальмита, эндокардит, сепсиса, бактериемии.
Инкубационный период при остром гастроэнтерите составляет от 1 до 16 часов. Болезнь имеет острое начало, ребенка тошнит, он жалуется на боли в животе. Повышения температуры обычно нет. Появляется рвота (возможно – многократная), а через несколько часов отмечают водянистую диарею. Отмечаются болезненные позывы на дефекацию («в туалет»). В некоторых случаях болезнь может проходить по аналогии с пищевой токсикоинфекции. Тогда, прежде всего, появляется профузная рвота, а диареи нет.
Острый гастроэнтерит может проходить в легкой или среднетяжелой форме. Тяжелые формы – очень большая редкость. Болезнь может длиться как несколько часов, так и 2 суток.
Пневмония, вызванная Bacillus cereus, начинается остро – появляется лихорадка и одышка. Появляются боли в области грудины. Рентген показывается Рентгенологически выявляется одно- или двусторонний инфильтративный процесс с поражением одной или нескольких долей легкого и вовлечением плевры. Пневмония может быть геморрагической, в таком случаи часты летальные исходы.
Менингит имеет острое начало, температура очень высокая, рвота повторная, развиваются менингеальные симптомы, повторные судороги. Состояние больного ребенка тяжелое. В спинномозговой жидкости обнаруживают значительный плеоцитоз, а лимфоциты и нейтрофилы наличествуют в равном количестве. В периферической крови может быть лейкоцитоз с нейтрофильным сдвигом. Симптомы проявляются довольно долго, не помогают препараты пенициллинового ряда.
Септицемия. Инфекционный процесс, вызванный Bacillus cereus, может проявляться септицемией с очагами воспаления или без них. Показательный симптом – упорная лихорадка, которая становится интермиттирующей (перемежающейся). Источник инфекции удается установиться не всегда (как и «входные ворота»). При данной форме инфекции В. cereus выделяется в чистой культуре.
Online-консультации врачей
| Консультация педиатра |
| Консультация эндоскописта |
| Консультация радиолога (диагностика МРТ, КТ) |
| Консультация психолога |
| Консультация гастроэнтеролога детского |
| Консультация педиатра-аллерголога |
| Консультация оториноларинголога |
| Консультация кардиолога |
| Консультация маммолога |
| Консультация общих вопросов |
| Консультация нейрохирурга |
| Консультация нефролога |
| Консультация инфекциониста |
| Консультация детского психолога |
| Консультация косметолога |
Новости медицины
Футбольные фанаты находятся в смертельной опасности,
31.01.2020
«Умная перчатка» возвращает силу хвата жертвам травм и инсультов,
28.01.2020
Назван легкий способ укрепить здоровье,
20.01.2020
Топ-5 салонов массажа в Киеве по версии Покупон,
15.01.2020
Новости здравоохранения
Глава ВОЗ объявил пандемию COVID-19,
12.03.2020
Коронавирус атаковал уже более 100 стран, заразились почти 120 000 человек,
11.03.2020
Коронавирус атаковал 79 стран, число жертв приближается к 3200 человек,
04.03.2020
Новый коронавирус атаковал 48 стран мира, число жертв растет,
27.02.2020
Кожа под микроскопом
По данным американских микробиологов (Grice 2011), на коже находится 1,8 м2 разнообразных мест обитания микроорганизмов, включая бактерии, грибы, вирусы, клещи.
Микрофлора делится на постоянную – резидентную (около 90 % микробов), факультативную (условно-патогенную) – около 9,5 % и случайную (транзиторную) – 0,5 %.
Согласно доктору медицинских наук Виктору Бондаренко, заведующему лабораторией генетики вирулентности бактерий Института эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, около 20 % микроорганизмов от общего числа обитает в полости рта (более 200 видов), 18–20 % приходится на кожные покровы, 15–16 % — на глотку, 2–4 % – на урогенитальный тракт у мужчин и примерно 10 % – на вагинальный биотоп у женщин, а больше всего микроорганизмов (до 40 %) – в желудочно-кишечном тракте (Бондаренко 2007).
Микробиом кожи определяется такими факторами, как pH, температура, влажность, уровень выработки кожного сала, окислительный стресс, диета, инфекции. Кожа обладает высокой обновляемостью клеток, поскольку она постоянно противостоит воздействию внешних факторов.
Микробиом кожи меняется от человека к человеку. Уникальный профиль микробиоты человека задается в зависимости от «экониши», на него также влияет количество света и влажности/сухости, число волосяных фолликулов, пол и возраст (Krajewska-Włodarczyk 2017).
Некоторые распространенные полезные и патогенные бактерии приведены в таблице ниже, а также в ранее опубликованных на портале статьях.
Таблица 1. Кожный микробиом
|
Нормальная микрофлора |
Патогенная микрофлора |
|
Streptococcus viridans (стрептококк зеленящий) – нормальные обитатели полости рта, глотки, носа. |
Staphylococcus aureus (золотистый стафилококк) |
|
Staphylococcus saprophyticus (стафилококк сапрофитный) – самый мирный из стафилококков, основное его место обитания – это стенка мочевого пузыря и кожа вблизи гениталий, поэтому нетрудно догадаться, что он является возбудителем цистита, которому больше подвержены женщины. |
Streptococcus pyogenes (стрептококк пиогенный, он же бета-гемолитический стрептококк группы А) – дает осложнения в виде ревматизма, поражая почки, сосуды мозга, сердце, суставы. |
|
Staphylococcus epidermidis (стафилококк эпидермальный) – обитает в различных областях слизистых и кожных покровов. Эпидермис – поверхностный слой кожи, отсюда и название. |
Streptococcus pneumoniae (пневмококк) – возбудитель пневмонии и менингита. |
|
Staphylococcus haemolyticus (стафилококк гемолитический) |
Pseudomonas aeruginosa (синегнойная палочка) |
|
Грибы рода Candida |
Klebsiella pneumoniae, ozaenae, rhinoscleromatis (клебсиеллы пневмонии, озены, риносклеромы) |
|
Непатогенные виды бацилл, коринебактерии и др. |
Yersinia enterocolitica, pseudotuberculosis (иерсинии энтероколита и превдотуберкулеза) |
Известно, что сухие участки кожи на предплечьях, ягодицах и кистях активно заселены бактериями вида Actinobacteria, Proteobacteria, Firmicutes и Bacteriodetes. Удивительной особенностью микробиоты этих зон является обилие граммотрицательных организмов. Когда-то считалось, что они колонизируют кожу редко. Интересно, что на этих участках разнообразие бактерий больше, чем в кишечнике или полости рта одного и того же человека. Кроме того, микроорганизмы «привязаны» к текущему участку тела. И, пересаженные из одной среды обитания в другую, например, с языка на лоб, не способны колонизировать новую территорию или изменить существующее в этой области микробное сообщество (Costello et al. 2009).
Как этому невидимому и густонаселенному миру удается относительно спокойно и мирно существовать друг с другом на таком ограниченном участке, как наша кожа?
Ответ кроется в гомеостазе.
Выводы
Мы написали эту статью, чтобы показать, что все классификации и споры о полезных и вредных бактериях условны.
Когда в 2008 году Национальные институты здравоохранения США затеяли крупный проект Human Microbiome Project, подобный столь же масштабному проекту по расшифровке генома человека, ученые хотели удовлетворить исследовательский интерес.
Тогда амбициозная задача ученых – понять наконец, как изменения в микробиоме сказываются на здоровье человека, – так и не была решена, равно как и расшифровка генома человека не дала окончательных ответов на то, как функционируют гены.
Ответы еще предстоит получить, и можно предположить, что они не будут однозначными.
Однако академические идеи были выхвачены из контекста и из-под чутких рук ученых, вынесены за пределы лабораторий и стали достоянием широкой публики, породив множество мифов и неверных интерпретаций.
То, что мы наносим на кожу «хорошие» бактерии и надеемся с их помощью победить «вредные» или принимаем внутрь препараты и считаем, что они безобидны, может тем не менее колебать баланс микроорганизмов
Вот почему очень важно прислушиваться к своему врачу и использовать правильные продукты и ингредиенты и только тогда, когда это действительно необходимо.