Антибиотики
Содержание:
- Значение пенициллина в медицине и последствия его открытия
- Кто изобрел пенициллин
- Обзор
- Роль растений
- Клинические проявления
- С УСТОЙЧИВОСТЬЮ БАКТЕРИЙ МОЖНО БОРОТЬСЯ
- Миф. Пероральные цефалоспорины такие же «сильные», как и парентеральные
- Фаготерапия
- Еще немного о 19 веке
- Что такое антибиотики
- Миф. Чтобы вылечиться побыстрее, нужны «сильные» антибиотики широкого спектра действия
- ПРЕДПОСЫЛКИ ПОЯВЛЕНИЯ НЕУЯЗВИМЫХ БАКТЕРИЙ
- Дальнейшее изучение плесени
- Выводы и перспективы
Значение пенициллина в медицине и последствия его открытия
 Антибактериальное вещество плесневого гриба, выделенное Александром Флемингом и усовершенствованное Флори, Чейном и Хитли, стало основой для создания множества различных антибиотиков. Как правило, каждый препарат активен в отношении определённого вида болезнетворных бактерий и бессилен против остальных. Например, пенициллин не эффективен против палочки Коха. Тем не менее, именно разработки первооткрывателя позволили Ваксману получить стрептомицин, ставший спасением от туберкулёза.
Антибактериальное вещество плесневого гриба, выделенное Александром Флемингом и усовершенствованное Флори, Чейном и Хитли, стало основой для создания множества различных антибиотиков. Как правило, каждый препарат активен в отношении определённого вида болезнетворных бактерий и бессилен против остальных. Например, пенициллин не эффективен против палочки Коха. Тем не менее, именно разработки первооткрывателя позволили Ваксману получить стрептомицин, ставший спасением от туберкулёза.
Эйфория 50-х годов прошлого века по поводу открытия и массового производства «волшебного» средства казалась вполне оправданной. Грозные заболевания, столетиями считавшиеся смертельными, отступили, и появилась возможность существенно улучшить качество жизни. Некоторые учёные столь оптимистично смотрели в будущее, что предрекали даже скорый и неминуемый конец любым инфекционным заболеваниям. Однако даже тот, кто придумал пенициллин, предупреждал о возможных неожиданных последствиях. И как показало время, инфекции никуда не исчезли, а открытие Флеминга можно оценивать двояко.
Положительный аспект
Терапия инфекционных заболеваний с приходом в медицину пенициллина изменилась радикально. На его основе были получены препараты, эффективные против всех известных возбудителей. Теперь воспаления бактериального происхождения лечатся довольно быстро и надёжно курсом инъекций или таблеток, а прогнозы на выздоровление почти всегда благоприятны. Значительно снизилась детская смертность, увеличилась продолжительность жизни, а смерть от родильной горячки пневмонии стала редчайшим исключением. Почему же инфекции как класс никуда не исчезли, а продолжают преследовать человечество не менее активно, чем 80 лет назад?
Отрицательные последствия
На момент обнаружения пенициллина было известно много разновидностей болезнетворных бактерий. Учёным удалось создать несколько групп антибиотиков, с помощью которых можно было справиться со всеми возбудителями. Однако в ходе применения антибиотикотерапии выяснилось, что микроорганизмы под действием препаратов способны мутировать, приобретая устойчивость. Причём новые штаммы образуются в каждом поколении бактерий, сохраняя резистентность на генетическом уровне. То есть люди своими руками создали огромное количество новых «врагов», которых до изобретения пенициллина не существовало, и теперь человечество вынуждено постоянно искать новые формулы антибактериальных средств.
Кто изобрел пенициллин
На главный вопрос, кто открыл пенициллин, имеется несколько противоречивых ответов, однако официально считается, что создатель пенициллина – шотландский профессор Александр Флеминг. С детства будущий изобретатель мечтал найти уникально лекарство, поэтому поступил в медицинскую школу на базе госпиталя Святой Марии, которую окончил в 1901 году. Колоссальную роль при открытии пенициллина сыграл Алмрот Райт, изобретатель вакцины против брюшного тифа. С ним Флемингу посчастливилось посотрудничать в 1902 году.
Учился молодой микробиолог в академии Килмарнок, затем переехал в Лондон. Уже в статусе дипломированного ученого Флемминг открыл существование penicillium notatum. Научное открытие было запатентовано, ученый после окончания Второй Мировой войны в 1945 году даже получил Нобелевскую премию. До этого работа Флеминга была не раз отмечена премиями и ценными наградами. Принимать антибиотики в целях эксперимента человек начал в 1932 году, а до этого исследования проводились преимущественно на лабораторных мышах.

Разработки европейских ученых
Основателем бактериологии и иммунологии является французский микробиолог Луи Пастер, который в девятнадцатом веке подробно описал пагубное воздействие почвенных бактерий на возбудителей туберкулеза. Всемирно известный ученый лабораторными методами доказал, что одни микроорганизмы – бактерии могут быть истреблены другими – плесневыми грибами. Начало научных открытий было положено, перспективы открывались грандиозные.
Известный итальянец Бартоломео Гозио в 1896 году в своей лаборатории изобрел микофеноловую кислоту, которую стали называть одним из первых антибиотических средств. Тремя годами позднее немецкие врачи Эммерих и Лов открыли пиоценазу – синтетическое вещество, способное снижать патогенную активность возбудителей дифтерии, тифа и холеры, демонстрировать устойчивую химическую реакцию против жизнедеятельности микробов в питательной среде. Поэтому споры в науке на тему, кто изобрел антибиотики, не стихают и в настоящее время.
Кто изобрел пенициллин в России
Два российских профессора – Полотебнов и Манассеин спорили на тему происхождения плесни. Первый профессор утверждал, что от плесени пошли все микробы, а второй был категорически против. Манассеин стал исследовать зеленую плесень и обнаружил, что вблизи ее локализации полностью отсутствуют колонии патогенной флоры. Второй ученый занялся изучением антибактериальных свойств такого натурального состава. Такая нелепая случайность в перспективе станет истинным спасением для всего человечества.
Русский ученый Иван Мечников изучил действие ацидофильных бактерий с кисломолочными продуктами, которые благотворно воздействуют на системное пищеварение. Зинаида Ермольева вообще стояла у истоков микробиологии, стала основательницей известного антисептика лизоцима, а в истории известна, как «Госпожа пенициллин». Свои открытия Флеминг реализовал в Англии, параллельно над разработкой пенициллина трудились отечественные ученые. Американские ученые тоже не сидели зря.

Изобретатель пенициллина в США
Американский исследователь Зельман Ваксман параллельно занимался разработкой антибиотиков, но на территории США. В 1943 году ему удалось получить эффективный в отношении туберкулеза и чумы синтетический компонент широкого спектра действия под названием стрептомицин. в дальнейшем было налажено его промышленное производство, чтобы с практической позиции уничтожить вредную бактериальную флору.

Обзор
За лекарствами от гриппа мы бегаем в аптеку, как в супермаркет за хлебом. Но вот антибиотики без назначения врача не покупаем, хотя рецепт на них тоже не требуется. Когда-то пенициллином победили сифилис, гангрену и сепсис, а его современные аналоги почему-то убивают печень, снижают иммунитет и вызывают дисбактериоз всего тела. За открытие антибиотиков дали Нобелевскую премию, а за их назначение современным врачам порой грозят расправой. Раньше антибиотики добавляли в губную помаду, а теперь — в куриные тушки. Где логика?
Антибиотики — такая «разношерстная» и многообразная группа препаратов, что разрешить все противоречия сложно. Но кое-что прояснить необходимо, особенно в свете надвигающейся на человечество угрозы кокков, спирохет, бацилл и прочих одноклеточных «миазмов».
Первый же парадокс антибиотиков — в их названии. Его предложил в 1942 году микробиолог Зельман Ваксман и явно погорячился, так как дословно с греческого это переводится как «против жизни». На самом же деле антибиотики — это оружие против жизни микробной и во имя жизни человеческой. Терминологические трудности сохранились до сих пор. Изначально к классу антибиотиков относили средства, уничтожающие бактерий (прокариот), затем добавились лекарства от простейших (одноклеточных эукариот), позже — противогрибковые препараты, теперь существуют даже противоопухолевые антибиотики. А вот противовирусные лекарства всегда стояли особняком. На вирусы антибиотики не действуют.
- Традиционно антибиотиками называли только средства природного происхождения. Поэтому первым антибиотиком в историю вошел пенициллин. На самом деле, значительно раньше в медицине стали применять другой антибактериальный препарат. Это краситель, синтезированный в 1908 году, — красный стрептоцид. 24 года им красили ткани, и только в 1932 году немец Герхард Домагк вылечил с его помощью группу зараженных стрептококком лабораторных мышей. За это ему позже была присуждена Нобелевская премия.
Роль растений
Растения являются важным источником противомикробных соединений, а традиционные целители уже давно используют их для профилактики или лечения инфекционных заболеваний. Недавно появился новый интерес к использованию натуральных продуктов для идентификации новых антибиотиков (определяемых как натуральные продукты с антибиотической активностью) и их применения при открытии антибактериальных препаратов в эпоху геномики. Фитохимические вещества являются активным биологическим компонентом растений, а некоторые фитохимические вещества, включая дубильные вещества, алкалоиды, терпеноиды и флавоноиды, обладают противомикробной активностью. Некоторые антиоксидантные пищевые добавки также содержат фитохимические вещества (полифенолы), такие как экстракт виноградных косточек, и демонстрируют антибактериальные свойства in vitro.
Фитохимические вещества способны ингибировать синтез пептидогликана, повреждать структуры микробных мембран, изменять гидрофобность поверхности бактериальных мембран, а также модулировать чувствительность кворума. С ростом резистентности к антибиотикам в последние годы изучается потенциал новых антимикробных препаратов, полученных из растений. Тем не менее можно сказать, что долгий период открытия антибиотиков подошел к концу.
Клинические проявления
Помощь при отравлении должна оказываться любому пациенту, у которого обнаруживают вероятные симптомы интоксикации. Грибы, вызывающие патологические изменения в организме чаще всего, изображены на фото.
| Вид | Особенности в развитии интоксикации | Характерные симптомы ранней стадии болезни | Характерные симптомы поздней стадии | Наличие специфического противоядия |
| Бледная поганка | Позднее развитие признаков интоксикации – через 10-18 часов после того, как гриб попал с пищей в организм; Наличие «светлого» промежутка -– общее состояние пострадавшего на несколько дней может улучшиться вплоть до исчезновения всех проявлений ранней стадии отравления | Превалирование на первой стадии заболевания признаков поражения нервной системы (возникает головная боль, нарушения зрения, головокружения, слабость). Часто выявляются признаки выраженного гастроэнтероколита, который характеризуется неукротимой рвотой, поносом, жаждой | На поздних стадиях болезни на первый план выступают симптомы нарушения работы печени и почек, что проявляется уменьшением общего количества мочи, нарастанием в крови уровня продуктов азотистого обмена, желтушностью кожи и слизистых, развитием признаков токсической энцефалопатии (комы). | Антидота нет, на ранней стадии лечение направлено на удаление токсинов из организма, на поздней стадии лечение посиндромное, направленное на купирование проявлений отравления. |
| Мухоморы | Ранее развитие симптомов – признаки заболевания возникают в период от 30 минут до нескольких часов после употребления грибов. | Возникновение в начальной стадии интоксикации обильного слюно- и потоотделения, сужение зрачков, появление психомоторного возбуждения, одышки, падение артериального давления. | Появление признаков угнетения ЦНС (бред, галлюцинации, спутанность сознания, судороги скелетной мускулатуры), поражения пищеварительного тракта (боль в животе). | На ранней стадии отравления доктор может рекомендовать введение атропина – вещество является прямым антагонистом мускарина, который в большом количестве содержится в мухоморах |
| Строчки | Появление первых признаков болезни через 6-12 часов после употребления грибов в пищу; | На ранних стадиях интоксикации возникают боль в животе, тошнота, спазмы в животе, многократная рвота и частый стул, головная боль; | При тяжелом отравлении проявляются симптомы почечно-печеночной недостаточности – желтуха, анемия, гематурия (появление крови в моче). | Специфического противоядия нет, лечение направлено на устранение симптомов. |
| Условно съедобные грибы | Признаки токсического поражения появляются от 30 минут до 3 суток от момента употребления грибов. | В подавляющем большинстве случаев признаки отравления этими грибами сходны с симптомами острого гастроэнтероколита (боль в животе, понос, рвота). | Через 24-72 часа все симптомы болезни проходят без следа. | Лечебные мероприятия помогают устранить неприятные симптомы. |
| Отравление съедобными грибами | Симптомы соответствуют проявлениям интоксикации определенными химическими соединениями | Сроки проявления признаков варьируют. | Эффективность терапии зависит от наличия специфического антидота. |
Бледная поганка может стать причиной смерти
Употребление в пищу даже минимального количества бледной поганки смертельно опасно для человека, и цена несвоевременно оказанной первой помощи – жизнь пострадавшего.
Мухоморы
Несмотря на распространенное мнение, мухоморы очень редко становятся причиной фатальных отравлений.
Сторчки – «хитрые обманщики»
Все об отравлении грибами расскажет видео в этой статье:
С УСТОЙЧИВОСТЬЮ БАКТЕРИЙ МОЖНО БОРОТЬСЯ
С возникновением и распространением устойчивых штаммов микроорганизмов борются, регулируя применение антибиотиков. Во многих развитых странах антибиотики отпускают строго по рецептам. Принимаются и другие меры. В настоящее время во всем мире запрещено использовать антибиотики медицинского назначения для консервации продуктов питания. Забой скота, подвергавшегося лечению антибиотиками или получавшего их в качестве стимуляторов роста, должен производиться по истечении времени выведения лекарств из организма животного, то есть в поступающем в продажу мясе не должно быть и следов препарата.
Другой подход к проблеме резистентности — создание новых лекарственных препаратов, способных побороть бактерии, ставшие устойчивыми к давно использующимся лекарствам. На разработку и внедрение нового антибиотика в среднем уходит 10 лет. Но несмотря на этот внушительный срок, научные коллективы и фармацевтические компании во многих странах мира продолжают заниматься выделением и синтезом новых антибактериальных веществ.
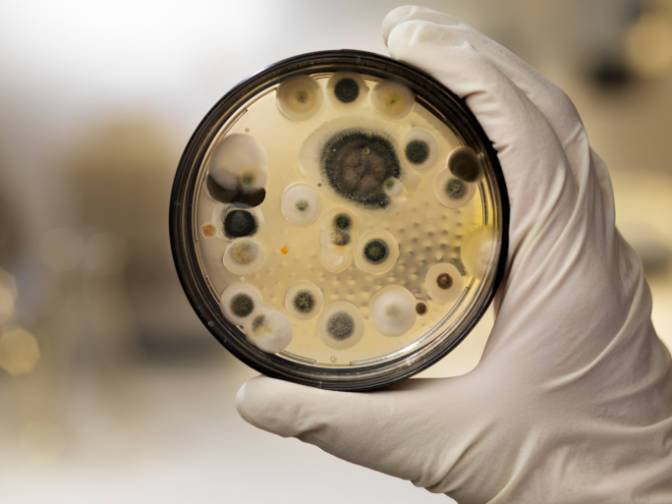
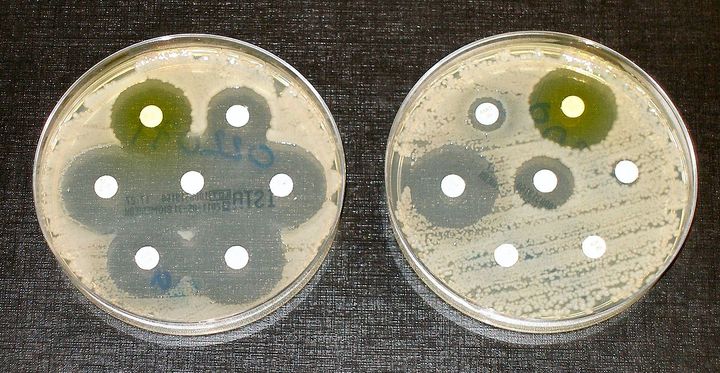 Тесты на устойчивость к антибиотикам: колонии бактерий видны в виде штрихов, а белые диски пропитаны антибиотиком. Бактерии в культуре на левой чашке чувствительны к антибиотику в каждом диске. В правой чашке чувствительность сохранена только к трем три из семи антибиотиков.
Тесты на устойчивость к антибиотикам: колонии бактерий видны в виде штрихов, а белые диски пропитаны антибиотиком. Бактерии в культуре на левой чашке чувствительны к антибиотику в каждом диске. В правой чашке чувствительность сохранена только к трем три из семи антибиотиков.
Насколько же осуществима задача поиска новых природных антибиотиков? Выше упоминалось, что основные известные продуценты антибактериальных соединений — это почвенные микроорганизмы — актиномицеты, бактерии и грибы. Начиная с 1950-х и по 1990-е годы исследова тели шли по «проторенной дорожке», продолжая заниматься поиском новых антибиотиков в одних и тех же живых микроорганизмах. Это можно объяснить не только инертностью мышления, но еще и тем, что в те годы промышленная база позволяла нарабатывать в ферментерах на жидких питательных средах огромное количество микробной массы почвенных микроорганизмов, производящих антибиотики.
Но наука не стоит на месте, и в последние пятнадцать-двадцать лет спектр организмов — продуцентов антибиотиков расширился. Среди них теперь числятся не только почвенные микробы, но также многие виды растений и животных. Как потенциальные производители антибиотиков очень перспективны высшие грибы, особенно те, которые можно культивировать в искусственных условиях. Развитие генетической инженерии не только делает такие объекты интересными в теоретическом плане, но и позволяет создавать рентабельные биотехнологические способы производства. Для получения больших количеств природных антибиотиков теперь вовсе не обязательно выращивать и перерабатывать тонны биомассы (живых организмов и высших растений). Антибактериальные вещества можно получать, встраивая гены «нужного» антибиотика в геном бактерий. В процессе жизнедеятельности бактерии нарабатывают желаемое лекарственное вещество, превращаясь в своеобразную фармацевтическую фабрику по производству антибиотиков.
В качестве примера растения — продуцента антибиотиков можно привести тихоокеанский тис. Из его коры выделяют таксол — противораковый антибиотик, применяемый для лечения рака яичников. Содержание таксола в коре тиса составляет всего лишь тысячные доли процента, поэтому одна терапевтическая доза препарата поначалу стоила около тысячи долларов. Сегодня цена значительно упала благодаря разработке способа получения таксола биотехнологическими методами.
 Лаборатория Флеминга в Лондоне, музей
Лаборатория Флеминга в Лондоне, музей
С развитием молекулярно-биологических методов получения природных соединений поиск новых антибиотиков даже в организмах высших животных и растений стал вполне экономически оправданным. Причем диапазон поиска практически не ограничен. По оценке венгерского профессора Яноша Берди, исследовавшиеся в той или иной степени живые организмы (а это не означает, что все они досконально изучены на молекулярном уровне) составляют лишь малую часть биоразнообразия нашей планеты. Ученый считает, что из существующих в природе 8-10 миллионов видов насекомых описана лишь десятая часть, из полутора миллионов бактерий — шесть тысяч.
В наше время удается даже открывать новые виды позвоночных животных, а уж не- открытых микроорганизмов вообще великое множество. Например, из почвы при использовании традиционных микробиологических методов высевается не более 0,1-10% присутствующих там микроорганизмов. Оставшиеся (так называемые «живые, но некультивируемые» микроорганизмы) еще не в полной мере изучены и представляют собой практически неисчерпаемый источник продуцентов новых антибиотиков.
Миф. Пероральные цефалоспорины такие же «сильные», как и парентеральные
Цефалоспорины (ЦС) — один из самых обширных классов антимикробных препаратов, представленных как в пероральной, так и парентеральной форме. При этом выраженность антибактериального эффекта в первую очередь определяется принадлежностью к одному из четырех поколений. Антибиотики цефалоспорины 1 поколения — парентеральный цефазолин и пероральный цефалексин — имеют самый узкий спектр активности, схожий со спектром аминопенициллинов (ампициллина, амоксициллина) . Цефалоспорины II поколения (парентеральный цефуроксим, пероральный цефаклор) активны в отношении грамотрицательных бактерий, при этом по действию на стафилококки и стрептококки они близки к предшественникам. Таким образом, мощность представителей антибиотиков первого и второго поколений практически не зависит от лекарственной формы. Но с цефалоспоринами последующих поколений всё не так просто.
Известно, что антибиотики 3 поколения обладают более высокой по сравнению с ЦС-I и ЦС-II активностью в отношении грамотрицательных бактерий, пневмококков и стрептококков. Однако их пероральные формы цефиксим и цефтибутен определенно обладают более узким спектром активности, чем парентеральные цефтриаксон, цефтазидим и цефоперазон. В частности, препараты для приема внутрь не действуют в отношении пенициллинорезистентных пневмококков, что связывают с их относительно невысокой биодоступностью. Так, биодоступность цефиксима составляет всего 40–50 %, в то время как у парентеральных форм она приближается к 100 % .
Тем не менее, цефиксим считается мощным антибиотиком, применение которого оправдано при инфекциях мочевыводящих путей, а также среднем отите и фарингите. Цефтибутен применяют гораздо реже: он показан только для терапии острых бактериальных осложнений хронического бронхита, среднего отита, фарингита и тонзиллита. Существенный недостаток этого препарата — низкая активность в отношении золотистого стафилококка . В то же время парентеральные цефалоспорины третьего поколения широко применяются для лечения тяжелых инфекций верхних, нижних дыхательных путей, желчевыводящих путей, мягких тканей, кишечных инфекций, сепсиса и других .
Фаготерапия
Фаготерапия — еще один метод лечения устойчивых к антибиотикам штаммов бактерий. Фаготерапия заражает патогенные бактерии собственными вирусами. Бактериофаги чрезвычайно специфичны для определенных бактерий, поэтому они не вредят организму-хозяину и микрофлоре кишечника в отличие от антибиотиков. Бактериофаги, также известные как фаги, заражают и могут убивать бактерии и влиять на рост бактерий прежде всего в течение литических циклов. Фаги вставляют свою ДНК в бактерию, где ее транскрибируют и используют для создания новых фагов, после чего клетка будет лизироваться, высвобождая новый фаг, способный заражать и уничтожать другие бактерии одного и того же штамма. Высокая специфичность фага защищает «хорошие» бактерии от разрушения.
Однако существуют и некоторые недостатки в использовании бактериофагов. Бактериофаги могут содержать факторы вирулентности или токсичные гены в своих геномах. Кроме того, пероральное и внутривенное введение фагов для уничтожения бактериальных инфекций представляет собой гораздо более высокий риск безопасности, чем местное применение, и есть дополнительная проблема неопределенного иммунного ответа на эти крупные антигенные коктейли. Существуют значительные регуляторные препятствия, которые необходимо преодолеть для таких рискованных методов лечения. Использование бактериофагов в качестве замены противомикробных препаратов остается привлекательным вариантом, несмотря на многочисленные проблемы.
Еще немного о 19 веке
В 1874 году врач сэр Уильям Робертс отметил, что культуры плесени Penicillium glaucum, которые используются при изготовлении некоторых видов голубого сыра, не проявляют бактериального загрязнения. В 1876 году физик Джон Тиндаль также внес свой вклад в эту область. Пастер провел исследование, в котором показано, что Bacillus anthracis не будет расти в присутствии связанной плесени Penicillium notatum.
В 1895 году итальянский врач Винченцо Тиберио опубликовал статью о антибактериальной силе некоторых экстрактов плесени.
В 1897 году докторант Эрнест Дюшен написал работу «Вклад в выведение микроорганизмов: антагонизм, антагонистическое мышление и патогены». Это была первая известная научная работа по рассмотрению терапевтических возможностей плесени в результате их антимикробной активности. В своем труде Дюшен предложил, чтобы бактерии и плесени участвовали в вечной битве за выживание. Дюшесен заметил, что E. coli была удалена с помощью Penicillium glaucum, когда они оба выросли в одной и той же культуре. Он также заметил, что, когда он инокулировал лабораторных животных смертельными дозами тифозных бацилл вместе с Penicillium glaucum, животные не умерли от брюшного тифа. К сожалению, военная служба Дюшенна после получения степени не позволила ему провести дальнейшие исследования. Дюшен умер от туберкулеза — болезни, которую теперь лечат антибиотиками.
И только Флеминг спустя более чем 30 лет предположил, что плесень должна выделять антибактериальное вещество, которое он назвал пенициллином в 1928 году. Дуэт, определивший историю открытия антибиотиков — Флеминг/Ваксман. Флеминг считал, что его антибактериальные свойства можно использовать для химиотерапии. Первоначально он характеризовал некоторые из его биологических свойств и пытался использовать сырой препарат для лечения некоторых инфекций, но не смог продолжить свое развитие без помощи подготовленных химиков. Никто не играл во всей этой эпопее такой решающей роли, как научный дуэт Флеминг/Ваксман, история открытия антибиотиков их не забудет.
Но в этой эпопее были и другие важные имена. Как уже упоминалось ранее, химикам удалось очистить пенициллин только в 1942 году, но до 1945 года он не стал широко доступным за пределами союзных военных. Позже Норман Хитли разработал технику обратной экстракции для эффективной очистки пенициллина навалом. Химическая структура пенициллина была впервые предложена Абрахамом в 1942 году, а затем позже подтверждена Дороти Кроуфут Ходжкин в 1945. Очищенный пенициллин проявлял сильную антибактериальную активность против широкого спектра бактерий и имел низкую токсичность у людей. Кроме того, его активность не ингибировалась биологическими компонентами, такими как гной, в отличие от синтетических сульфонамидов. Развитие потенциала пенициллина привело к возобновлению интереса к поиску антибиотических соединений с аналогичной эффективностью и безопасностью. Цейн и Флори разделили Нобелевскую премию 1945 года в области медицины с Флемингом, открывшим эту чудо-плесень. Открытие антибиотиков Ермольевой было ожидаемо проигнорировано западным научным сообществом.
Что такое антибиотики
С момента появления первого антибиотика прошло уже много десятилетий, но об этом открытии хорошо знают медицинские работники во всем мире, простые обыватели. Сами по себе антибиотики – это отдельная фармакологическая группы с синтетическими компонентами, цель которых – нарушить целостность мембран патогенных возбудителей, прекратить их дальнейшую активность, незаметно вывести из организма, предотвратить общую интоксикацию. Первые антибиотики и антисептики появились в 40-х годах прошлого века, с того времени их ассортимент значительно пополнился.
Полезные свойства плесени
От повышенной активности болезнетворных бактерий хорошо помогают антибиотики, которые были выработаны из плесневых грибов. Лечебное действие антибактериальных препаратов в организме системное, все это благодаря полезным свойствам плесени. Первооткрывателю Флемингу лабораторным методом удалось выделить пенициллин, польза такого уникального состава представлена ниже:
- зеленая плесень подавляет бактерии устойчивые к другим лекарственным средствам;
- польза плесневого грибка очевидна при лечении брюшного тифа;
- плесень истребляет такие болезненные бактерии, как стафилококки, стрептококки.
Миф. Чтобы вылечиться побыстрее, нужны «сильные» антибиотики широкого спектра действия
Правда. Все зарегистрированные антибактериальные препараты можно смело относить к мощным, то есть «сильным», однако выраженность их противомикробного эффекта зависит от множества факторов, объединенных принципами антибиотикотерапии :
- Установка диагноза настолько точная, насколько это возможно. Знание диагноза позволяет определить предполагаемого возбудителя.
- Определение возбудителя, если это возможно.
- Принятие взвешенного решения о необходимости назначения антибиотиков.
- Подбор оптимального антибиотика с учетом фармакокинетики и спектра активности.
- Подбор оптимальной дозы и курса лечения (последний при большинстве острых инфекций должен составлять не менее 5–10 дней).
- Контроль эффективности антибиотикотерапии.
В российских реалиях, когда контроль за приемом антибиотиков, откровенно говоря, недостаточен, особенно остро стоит вопрос некорректного подбора препаратов. Известно, что его осуществляют двумя способами: этиотропным и эмпирическим. В первом случае антибиотик применяется целенаправленно против определенного, точно установленного возбудителя. Без сомнения, это рационально и оправданно. Однако идентификация микроорганизма, вызвавшего инфекцию, требует времени, обычно это занимает несколько суток. Когда процесс протекает остро и больному требуется немедленная помощь, выделение возбудителя — неоправданная роскошь. В такой ситуации назначают эмпирическую терапию, подбирая препарат с учетом наиболее вероятных возбудителей . Например, самый частый возбудитель пневмонии — пневмококк, цистита — кишечная палочка и так далее.
Если антибиотик был подобран корректно и все остальные принципы антибиотикотерапии были соблюдены, он, без сомнения, окажется «сильным». А вот тот же препарат, применяемый неправильно (независимо от того, на каком этапе была сделана ошибка), может проявить «слабость» и не оказать терапевтического действия.
ПРЕДПОСЫЛКИ ПОЯВЛЕНИЯ НЕУЯЗВИМЫХ БАКТЕРИЙ
Штаммы устойчивых болезнетворных бактерий появляются в местах скопления людей с ослабленным иммунитетом. Поэтому чаще всего суперустойчивые бактерии встречаются в больницах, роддомах, домах престарелых, тюрьмах. Отсюда и термин «госпитальные», или «внутрибольничные», инфекции. Чем дольше пациент находится в клинике, тем выше вероятность заражения госпитальными инфекциями.
Распространенность таких больничных инфекций зависит от страны, региона и меняется со временем. Так, в США средняя частота возникновения госпитальных инфекций в отделениях реанимационной педиатрии составляет 6,1%, а во Франции — 23,5%. В клиниках Москвы и Санкт-Петербурга частота встречаемости устойчивой формы стафилококка MRSA в 1998 году составляла от 0 до 40%, а теперь в отдельных столичных больницах доходит до 80%.
Кроме того, патогенные микроорганизмы, устойчивые к большинству антибиотиков, в последнее время стали распространяться среди вполне здоровых людей. Процесс очень трудно контролировать и еще труднее предотвратить. Так, в США ученые обнаружили, что устойчивые штаммы золотистого стафилококка MRSA распространяются среди спортсменов, вступающих в непосредственный контакт (например, среди борцов) или соприкасающихся с каким-то общим предметом, например с мячом, как это происходит при игре в гандбол или баскетбол. Описаны случаи распространения MRSA в школьных спортивных командах.
 Плакат на обочине дороги во во время Второй мировой войны для военнослужащих: пенициллин излечивает гоноррею за 4 часа
Плакат на обочине дороги во во время Второй мировой войны для военнослужащих: пенициллин излечивает гоноррею за 4 часа
Чем шире используются антибиотики, тем чаще возникают и распространяются бактерии, потерявшие к ним чувствительность. Поэтому особенно опасно неконтролируемое применение антибактериальных препаратов без предписания врача. Зачастую при самостоятельно поставленном диагнозе «простуда» многие начинают принимать антибиотики, предназначенные для лечения бактериальных инфекций. Но не следует забывать, что за так называемой простудой могут скрываться самые разные инфекционные заболевания, в том числе и вирусные (например, грипп), против которых применять антибактериальные препараты не просто бесполезно, а даже вредно. Эффекта от такого лечения никакого, но в организме нарушается естественная бактериальная флора, в результате чего могут развиться оппортунистические инфекции, например кандидоз (неконтролируемый рост дрожжевых грибов рода Candida). Кроме того, возникает ничем не оправданный риск появления в организме устойчивых бактериальных штаммов.
Другая распространенная ошибка при лечении заключается в том, что больной при улучшении самочувствия раньше времени отказывается от выписанного антибиотика или принимает его в более низкой дозе по сравнению с назначенной врачом. Это опасно тем, что приводит к увеличению вероятности выработки лекарственной устойчивости у болезнетворной бактерии; следовательно, последующая попытка лечения этим же антибиотиком будет неэффективна.
Иногда при лечении антибактериальными препаратами устойчивость к лекарствам вырабатывается у бактерий, составляющих микрофлору человека. Такие «свои» устойчивые бактерии могут передавать гены резистентности чужеродным бактериям, вызывающим различные болезни. В результате межвидового обмена генами возбудители инфекции тоже становятся устойчивыми.
Дальнейшее изучение плесени
Но информация об истории открытия антибиотиков не ограничивается 20-ми годами прошлого века. В течение следующих двенадцати лет Флеминг выращивал, распределялся и изучал интересную плесень, которая была признана редким видом Penicillium notatum (теперь Penicillium chrysogenum). Многие более поздние ученые были вовлечены в стабилизацию и массовое производство пенициллина и в поисках более продуктивных штаммов Penicillium. Список этих ученых включает Эрнста Чейна, Говарда Флори, Нормана Хитли и Эдварда Абрахама. Вскоре после открытия пенициллина ученые обнаружили, что некоторые болезнетворные патогены проявляют антибиотическую резистентность к пенициллину. Исследования, направленные на развитие более эффективных штаммов и изучение причин и механизмов устойчивости к антибиотикам, продолжаются и сегодня.
Выводы и перспективы
Получается, что открытие Флеминга было ненужным и даже опасным? Конечно же, нет, поскольку к таким результатам привело исключительно бездумное и бесконтрольное использование полученного «оружия» против инфекций. Тот, кто изобрел пенициллин, ещё в начале 20 века вывел три основных правила безопасного применения антибактериальных средств:
- выявление конкретного возбудителя и использование соответствующего препарата;
- достаточная для гибели возбудителя дозировка;
- полный и непрерывный курс лечения.
К сожалению, люди редко следуют этой схеме. Именно самолечение и небрежность стали причиной появления бесчисленных штаммов болезнетворных микроорганизмов и трудно поддающихся антибактериальной терапии инфекций. Само же открытие пенициллина Александром Флемингом – это великое благо для человечества, которому всё ещё нужно учиться использовать его рационально.