Фиброма матки: лечение, диагностика и симптомы заболевания
Содержание:
- Удаление доброкачественных образований мягких тканей в Операционной №1 г. Александров
- Причины опухолей почки
- Симптомы опухолей брюшины
- Чудо Доктор на Школьной 46
- Лапароскопическая операция по удалению миомы матки отличается от традиционной хирургии в нескольких ключевых направлениях
- Классификация миом
- Фиброма – причины
- Радиохирургическая методика
- Диагностика фиброаденомы
- Лечение фибромы матки
- Материалы и методы
- Ведущие врачи
- Как ушивают диастаз?
- Типы фибром полости рта
Удаление доброкачественных образований мягких тканей в Операционной №1 г. Александров
Доброкачественная опухоль – это новообразование в мягких тканях тела, которое бывает приобретенным или врожденным. При такой болезни функции клеток меняются, ткани разрастаются, появляется гиперплазия. Приобретенные опухоли – это последствия хронических воспалительных процессов в мягких тканях, коже, слизистых оболочках. Они развиваются после травм, солнечных или рентгеновских ожогов, облучения, воздействия химических веществ. Доброкачественные новообразования растут медленно, иногда могут напоминать злокачественные опухоли. Для дифференциальной диагностики проводят клинические исследования, биопсию.
Причины опухолей почки
КТ почек
Стоимость: 10 000 руб.
Подробнее
Ученые до сих пор затрудняются назвать все причины, которые могут привести к развитию опухолевого процесса. Известно о некоторых факторах риска:
- Возрастные и половые особенности. Чаще всего болеют представители сильного пола в возрасте от 45 лет.
- Курение. У постоянных курильщиков риски возрастают вдвое.
- Избыточный вес. Доказано, что ожирение коррелирует с повышенной вероятностью заболеть раком почки.
- Гипертония, хронические заболевания сердца и сосудов.
- Хронические заболевания почек, хроническая почечная недостаточность.
- Прием некоторых лекарственных препаратов.
- Наследственные факторы: наличие рака у родственников первой линии.
Сочетание сразу нескольких факторов риска увеличивает вероятность развития опухоли в разы.
Симптомы опухолей брюшины
Доброкачественные опухоли брюшины, как правило, протекают бессимптомно, за исключением ситуаций, когда они достигают крупных размеров и сдавливают окружающие органы. Выявляются доброкачественные опухоли зачастую случайно.
Симптомы злокачественных опухолей брюшины включают в себя симптомы, характерные для любых злокачественных опухолей — интоксикацию, анемию, похудение, снижение аппетита, которые обычно проявляются, когда опухоль достигает существенных размеров, и специфические, обусловленные конкретной локализацией. К последней группе можно отнести болевой синдром, нарушение функции сдавливаемых опухолью органов, появление асцита. При массивных опухолях, сдавливающих кишечник, возможно нарушение проходимости кишечника, вплоть до развития кишечной непроходимости, требующей экстренного хирургического вмешательства.
Чудо Доктор на Школьной 46
Филиал клиники Чудо Доктор, расположенный на Школьной улице (д. 46) — это центр доказательной медицины с командой врачей различных направлений и оснащением экспертного уровня.
В филиале пациенты получают помощь по всем основным направлениям современной медицины:
– терапевтические направления медицины (терапия, неврология, эндокринология, гастроэнтерология и другие),
– восстановительная медицина (физиотерапия, мануальная терапия),
– дерматология, лечебная и эстетической косметология, направленная на улучшение внешности и коррекцию контуров тела,
– узкие специальности, такие как гематология, ревматология, диетология, психология.
Лапароскопическая операция по удалению миомы матки отличается от традиционной хирургии в нескольких ключевых направлениях
- Во время лапароскопической операции хирург не смотрит в брюшную полость непосредственно через большой разрез поперек живота, а выполняет операцию, глядя на большой видеомонитор.
- Чтобы быть успешной сама операция и, особенно, ушивание матки, которая необходима во время лапароскопической миомэктомии, требуют большой зрительно-моторной координации и ловкости, а также знание анатомии области таза
- Процедура безопасна и эффективна, когда выполняется надлежащим образом, хорошо подготовленным специалистом. Процедура на самом деле сложная, поэтому к подготовке и соответствующему опыту врача, выполняющему её, предъявляются большие требования, чем при абдоминальной хирургии.
Консервативное удаление миомы проводят в четыре этапа:
- 1. Отсечение и вылущивание миоматозных узлов.
- 2. Восстановление дефектов миометрия – ушивание раны матки.
- 3. Извлечение миоматозных узлов.
- 4. Гемостаз и санация брюшной полости.
Показания к консервативной миомэктомии
- Размеры миомы матки 12 недель беременности и более у женщин репродуктивного возраста.
- Наличие хотя бы одного миоматозного узла диаметром более 3.5 см у женщин, планирующих беременность.
- Наличие миомы любых размеров при невынашивании беременности и бесплодии, если исключены другие причины этой проблемы.
- Миома, вызывающая кровотечения, из-за деформации полости и нарушения сократительной способности матки, что приводит к анемии у женщины репродуктивного возраста.
- Быстрый рост миомы — более 4 недель беременности за год.
- Синдром тазовых болей, возникающий в результате нарушения кровообращения в миоматозных узлах.
- Нарушение функции смежных органов (мочевого пузыря, кишечника) за счёт их механического сдавливания опухолью.
Противопоказания к лапароскопическому удалению миомы матки
- Декомпенсация заболеваний сердечно-сосудистой и дыхательной системы, сахарный диабет, печеночная недостаточность, заболевания крови и некоторые другие заболевания. Для определения противопоказаний необходима консультация терапевта или специалиста соответствующего профиля.
- Злокачественные заболевания эндометрия и шейки матки. При подозрении на малигнизацию до операции необходимо оценить состояние органов при помощи онкоцитологии, но более информативна, конечно, биопсия.
- Выраженный спаечный процесс после ранее перенесенных операций, а также ожирение II-III степени являются относительными противопоказаниями.
- Проведение консервативной миомэктомии при множественной миоме матки требует взвешенного подхода из-за высокой частоты рецидивов (от 30% и выше), в то время, как при одиночных узлах не более 10-20 %.
Противопоказания к выполнению миомэктомии лапароскопическим доступом в определенной степени относительны и зависят от профилактики кровотечения во время операции и владения хирургом техникой эндоскопического шва. Несмотря на преимущества лапароскопического доступа, лечение «трудных» миом, которые имеют следующие характеристики: размеры более 7-8 см, расположены интерстициально с центрипетальным ростом, перишеечно, по задней стенке матки, интралигаментарно и в области ребра матки, ранее имело ограничения. Это было связано с высоким риском осложнений, таких как: кровотечение при выделении узла, вероятность конверсии (переход на традиционную операцию – с лапаротомией), формирование ненадежного рубца на матке вследствие плохой визуализации раны в условиях продолжающегося кровотечения и активного использования в таких условиях электрохирургии.
Для решения этой проблемы в клинике высоких медицинских технологий им. Н. И. Пирогова с 2010 года используется методика временной предоперационной эмболизации маточных артерий.Благодаря этому нам удается решить проблемы стандартной техники лапароскопической миомэктомии: операция проводится без кровопотери, с минимальным электрохирургическим воздействием на миометрий, что позволяет выделить узел без травмы окружающих тканей и надежно ушить рану на матке в условиях хорошей визуализации. А это необходимо для последующей беременности и родов.
Классификация миом
Матка женщины состоит из двух частей: тела (верхняя часть) конусовидной формы и более узкой шейки, переходящей книзу во влагалище. Соответственно, различают миомы тела матки, на которые приходится 95% всех случаев, и миомы шейки матки, которые встречаются в 5% случаев.
Стенка матки представлена тремя слоями. Внутри она выстлана слизистой оболочкой — эндометрием. Средний слой представлен гладкомышечной тканью, это миометрий. Снаружи орган «заламинирован» серозной оболочкой — периметрием. Миоматозные узлы могут находиться в разных частях миометрия, ближе к серозной оболочке или полости матки. От этого зависят симптомы заболевания и тактика лечения. В зависимости от расположения по отношению к стенке органа, классификация миом, разработанная Международной федерацией гинекологии и акушерства (International Federation of Gynecology and Obstetric, FIGO), выделяет восемь типов узлов:
- Тип 0 — субмукозная (подслизистая) миома на ножке, которая выступает в полость органа.
- Тип 1 — <50% интрамуральная. Узел, который находится под эндометрием и более чем наполовину выступает в полость матки.
- Тип 2 — >50% интрамуральная. Узел находится под эндометрием и выступает в полость матки менее чем наполовину.
- Тип 3 — интерстициально-субмукозный узел, находится в мышечном слое и примыкает к слизистой оболочке.
- Тип 4 — интрамуральная миома, находится в толще миометрия.
- Тип 5 — интерстицио-субсерозная, менее чем на 50% выступает над наружной поверхностью матки.
- Тип 6 — субсерозная на широком основании — более чем на 50% выступает над наружной поверхностью матки.
- Тип 7 — субсерозный узел, который выступает над поверхностью матки на ножке.
У некоторых женщин миоматозные узлы имеют смешанную локализацию. Например, может быть обнаружено несколько узлов, находящихся в разных местах, или один большой узел, который одновременно выступает и над поверхностью матки, и выпячивается внутрь ее полости.
Во время гистероскопии — эндоскопического исследования полости матки — видны только узлы, которые находятся под слизистой оболочкой. Для них существует специальная классификация, предложенная Wamsteker и deBlok:
- Субмукозные миомы на ножке без интрамурального (внутристеночного) компонента.
- Субмукозные узлы на широком основании — выступают в полость органа более чем на 50%.
- Узлы с интрамуральным компонентом более 50%.
Европейское Общество Репродукции Человека (ESHRE) предлагает классифицировать миомы матки в зависимости от размеров:
- Небольшие — до 5 сантиметров.
- Большие — более 5 сантиметров.
В зависимости от внешнего вида ткани узлов под микроскопом, выделяют гистологические типы миом:
- Обычная.
- Пролифирирующая.
- Причудливая.
- Клеточная.
- Эпителиоидная.
- Внутрисосудистый лейомиоматоз.
- Лейомиома с явлениями предсаркомы.
На данный момент известно, что все гистологические типы миом обладают той же склонностью к озлокачествлению, что и обычная лейомиома. Иными словами, ни одна из них не создает повышенного риска развития онкологического заболевания. Злокачественные опухоли миометрия называются лейомиосаркомами, и они являются одними из самых редких злокачественных новообразований в организме человека.
Фиброма – причины
- Наследственная предрасположенность (если у кровных родственников имеются или были фибромы, то с высокой степенью вероятности данные опухоли будут образовываться и у человека, состоящего с ними в родстве);
- Неблагоприятная экологическая обстановка;
- Травматические повреждения органов или тканей (укусы насекомых, высыпания на коже, аборты, диагностические выскабливания, ушибы, тяжелые роды и др.);
- Инфекционные заболевания, нарушающие структуру клеток и тканей различных органов (например, ветрянка, туберкулез, угри, гепатиты и др.);
- Хронические длительно текущие воспалительные процессы;
- Склонность к прыщам, угрям и другим высыпаниям на коже (только для фибром, локализованных на кожном покрове);
- Временный иммунодефицит;
- Гормональный сбой, спровоцированный любыми причинами;
- Паразитарные заболевания (трихомониаз и др.);
- Прием препаратов группы бета-блокаторов (Атенолол, Метопролол, Пропранолол и др.);
- Стрессы;
- Эндокринные заболевания (сахарный диабет, гипотиреоз, гипертиреоз и др.).
Радиохирургическая методика
Современный атравматический метод – это радиоволновая хирургия. Она дает возможность проводить процедуру бесконтактного разреза и спаивания сосудов тканей эпидермиса за счет действия радиоволн. Рассечение кожного покрова проводится благодаря высокой энергии, которая позволяет преодолеть сопротивление кожи при ее контакте с радиоволнами. При воздействии луча клетки испаряются, а эпидермис расходится в необходимой зоне.
Главным достоинством методики при сравнении с лазерным способом удаления является возможность врача-хирурга контролировать процесс. Именно за счет этого достигается точность глубины разреза. Благодаря высокой эффективности и простоте осуществления радиоволновой метод нашел широкое применение в косметологии. К тому же он позволяет добиться гарантированного результата в решении многих косметических проблем.
Эта методика находит широкое использование и в других отраслях, в том числе дерматологии и гинекологии для максимально щадящего удаления:
- доброкачественных образований на поверхностном слое эпидермиса или слизистой оболочки;
- образований при вирусной инфекции;
- папиллом;
- эрозии шейки матки.
Процедура не приводит к появлению крови, она не занимает много времени и не требует длительной реабилитации.
Диагностика фиброаденомы
Все начинается с беседы, во время которой женщине нужно рассказать обо всех подробностях своей жизни: менструальном цикле, беременностях и родах, хронических и перенесенных заболеваниях, наследственности и вредных привычках. Далее происходит физикальный осмотр молочных желез и регионарных лимфатических узлов.
Женщинам до 40 лет назначается УЗИ молочных желез, а по показаниям другие клинические обследования, после чего становится понятным характер опухоли. Женщинам старше 40 может быть назначено рентгенологическое исследование (маммография), уточняющее наличие кальцинатов или признаков озлокачествления.
Для уточнения диагноза врачи ЦЭЛТ могут использовать такие дополнительные методы обследования:
- молочных желез;
- РТМ-исследование или радиотермия, при котором фиксируется температура в разных квадрантах с точностью до полуградуса, метод позволяет выявить участки гипертермии (повышения температуры);
- Биопсия образования (при подозрении на злокачественный характер процесса) для гистологической верификации диагноза;
- ;
- исследование гормонального статуса – уровень эстрадиола, пролактина, прогестерона в крови;
- анализ крови на онкомаркеры;
- генетическое исследование;
- цитологический анализ выделений из соска.
Важно не пропустить начало злокачественного процесса, для этого надо вовремя обратится к врачу, а врачи ЦЭЛТ используют все возможные методы диагностики, на основании которых можно отличить доброкачественную опухоль от злокачественной
Лечение фибромы матки
Терапия фибромы заключается в анализе анамнеза и изучении особенностей организма каждой пациентки. Например, женщинам не планирующим рожать или потерявшим такую возможность из-за почтенного возраста, может быть показано удаление матки, а для молодых девушек, которые еще собираются рожать ребенка, подбирают более щадящий метод лечения — малоинвазивный или с использованием миомэктомии. Фиброма шейки матки, симптомы и лечение опухоли зависят исключительно от гормонального фона женщины, её возраста и индивидуальных реакций организма на те или иные манипуляции.
Во время терапии фибромы матки могут использовать следующие методы:
- органосохраняющая операция;
- лапаротомия;
- лапароскопия;
- гистерорезектоскопия;
- миомэктомия;
- ампутация надвлагалищной части матки.
Каждая женщина с диагнозом «фиброма матки» должна находиться под наблюдением специалистов: гинеколога и гинеколога-эндокринолога. Доктора могут следить за развитием новообразования, контролировать его рост и наблюдать за симптоматикой. Если опухоль не тревожит пациентку, то не стоит начинать лечение.
Когда опухоль значительно увеличивается, проявляются первые симптомы, свидетельствующие о развитии заболевания, необходимо применять гормональную терапию. Лечение такого типа основывается на снижении выработки организмом эстрогена. Для такой цели подходят гормоны Гестринон и Даназол. К сожалению, применение гормонов несет в себе множество негативных последствий: разрежается костная ткань, боль в спине, могут наблюдаться некие сбои в работе кишечника, лишний вес.
Эффективностью в лечении фибромы матки отличилась Система гормонального воздействия — внутриматочное противозачаточное средство «Мирена», основной составляющей которого является гестагенный гормон, способный остановить рост фиброидной опухоли матки. Остановить рост узлов, размерами до двух сантиметров, можно при помощи КОК — Жанин, Регулон, Ярина.
Применение гормональных препаратов для лечения фибромы — не единственный способ лечения. Зачастую доктора прописывают целый ряд симптоматических препаратов: спазмолитики, всевозможные витамины и добавки, препараты с содержанием железа.
Оперативный метод применяют при больших фиброидных узлах, омертвлению тканей и четко выраженных симптомах.
Если женщина собирается рожать ребенка, то во время беременности будут применяться меры по сохранению органа. Такие операции предусматривают энуклеацию узла фибромы с сохранением функциональности матки.
На назначения консервативной терапии миомы матки влияют следующие факторы:
- показатели размера тела опухоли до двенадцатой недели вынашивания плода в случае беременности;
- локализация узлов фибромы под брюшной полостью и в глубине мышечных тканей;
- отсутствие четко выраженной симптоматики;
- положительные тенденции к применению оперативного метода;
- направленность на сбережение детородной функции пациентки;
- подготовка к проведению оперативного вмешательства и реабилитационный период, который длится в среднем две недели.
Самым современным методом является хирургическое вмешательство, предусматривающее закрытие сосудистых просветов, питающих маточную фиброму. Блокируемый доступ крови к опухоли останавливает рост узла. Своею радикальностью отличается ампутация матки — гистерэктомия.
Осложнения и прогноз при фиброме матки могут быть спровоцированы перекрутом ножки, омертвлением опухолевого узла и возможными кровоизлияниями. Перекрут ножки обычно имеет симптомы острого живота, а омертвление сопровождается лихорадкой. При сильно выраженных кровотечениях фиброма матки может стать причиной развития малокровия. Серьезные осложнения могут возникнуть после оперативного вмешательства: инфекционное заражение, кровотечение, образование спаек в полости малого таза, развитие синехии внутри матки. После применения консервативной терапии, более половины пациенток восстанавливают репродуктивную функцию и рождают здоровых деток. Если терапия опухоли не носила столь радикальный характер, то существует угроза повторного образования и прогрессирования, новых фиброидных опухолей.
Материалы и методы
В клинику «В надежных руках» в ноябре 2019 года обратилась пациентка Ч. 35 лет с жалобами на новообразование передней брюшной стенки, болезненное при пальпации, дизурические явления.
Из анамнеза: заболела около 2 месяцев назад, когда появилось новообразование передней брюшной стенки, иногда отмечает болезненность в области новообразования.
В гипогастрии справа от срединной линии на 5 см ниже пупка до области лона плотное новообразование до 10 см, не смещаемое пальпаторно, не отделимое от прямой мышцы живота. Живот при пальпации локально болезненный в области нижнего края новообразования.
В анамнезе 4 месяца назад роды путем кесарева сечения. Послеоперационный рубец по Пфаннештилю, без особенностей.
Лабораторные анализы: без особенностей.
При выполнении УЗИ органов брюшной полости: в мягких тканях гипогастрия справа, в толще прямой мышцы, определяется солидное объемное образование низкой акустической плотности, гетерогенной структуры, размером до 90,5×30,5 мм в поперечнике. В режиме доплеровского картирования определяется интра- и пе- ринодулярная артериальная перфузия.
Выполнена тонкоигольная биопсия новообразования. Заключение: фасциит, воспалительный миозит.
КТ органов брюшной полости: объемное новообразование в толще правой прямой мышцы живота, без признаков инвазии в передний и задний листки апоневроза прямой мышцы живота, брюшную полость. Колоноскопия: без признаков патологии. Консультирована гинекологом, проведена дифференциальная диагностика с эндометриозом послеоперационного рубца. Эндометриоз послеоперационного рубца исключен. Гинекологическая патология исключена. Консультирована урологом. Дизурические явления обоснованы механическим давлением новообразования на стенку мочевого пузыря.
Пациентке выставлен диагноз «новообразование передней брюшной стенки», показано оперативное лечение. Проведена предоперационная подготовка. Оперативный доступ выполнен по Пффаненштилю с иссечением старого послеоперационного рубца после кесарева сечения. Кожа и подкожно-жировая клетчатка отслоены справа от срединной линии электрокоагуляцией до уровня пупка.
При дальнейшей ревизии: новообразование до 10×8 см плотной консистенции, располагающееся в толще прямой мышцы живота.
Рассечен передний листок влагалища прямой мышцы живота над новообразованием вертикальным доступом длиной около 10 см, выполнена его тракция зажимами от новообразования (рис. 1).
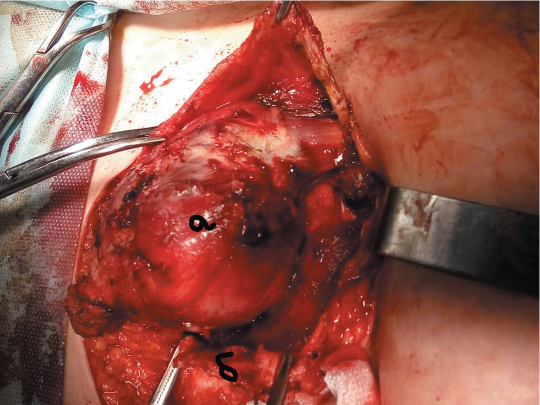
Рисунок 1. Новообразование прямой мышцы живота (десмоид): а — новообразование; б — передний листок влагалища прямой мышцы живота
Figure 1. Rectus abdominis muscle neoplasm (desmoid tumour); a — neoplasm, б — rectus sheath anterior lamina
Новообразование поэтапно вылущено в операционную рану, зажимами отсечено от неизмененных тканей прямой мышцы живота. Выполнен гемостаз. За новообразованием располагается неизмененный задний листок влагалища прямой мышцы живота. Образование удалено, отправлено на патогистологическое исследование (рис. 2, 3).
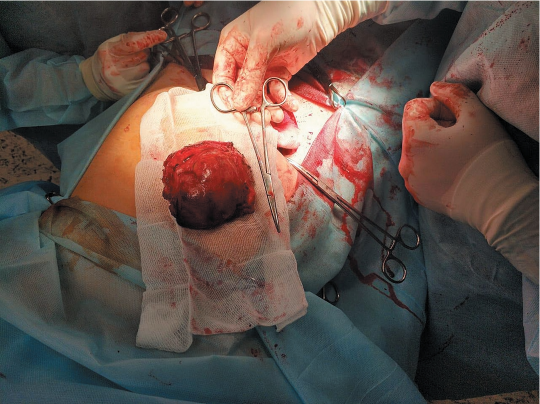
Рисунок 2. Удаленное новообразование прямой мышцы живота
Figure 2. Rectus abdominis muscle neoplasm removed
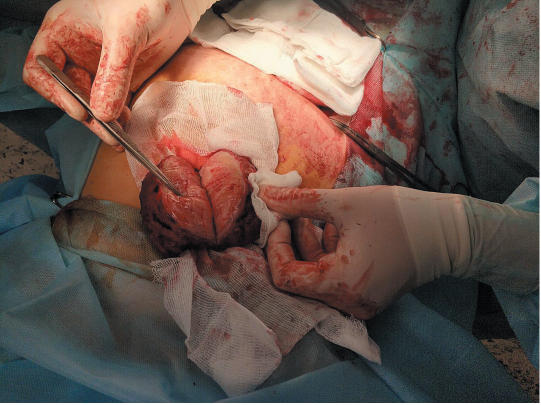
Рисунок 3. Вид новообразования на разрезе
Figure 3. Neoplasm cross section
На дно послеоперационной раны установлен дренаж по Редону. Над ним сведены узловыми швами края отсеченной прямой мышцы живота и передний листок влагалища апоневроза прямой мышцы живота. Учитывая операционную травму, принято решение выполнить укрепление мышечно-апоневротического слоя сетчатым протезом. Полипропиленовый сетчатый протез фиксирован к лону, вдоль паховой связки, и, латерально отступив более 5 см от линии шва переднего листа влагалища прямой мышцы живота, узловыми швами (рис. 4).
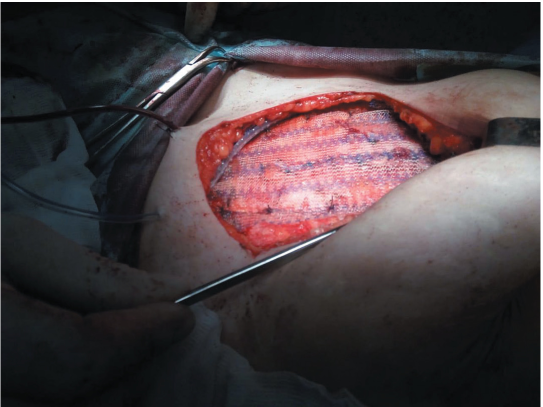
Рисунок 4. Вид передней брюшной стенки после фиксации сетчатого протеза
Figure 4. Anterior abdominal wall following fixation of mesh implant
Подкожно-жировая клетчатка дренирована по Редону, ушита узловыми швами. Кожа ушита интрадермальным швом.
Послеоперационный период протекал без особенностей. Швы сняты, послеоперационные раны без признаков воспаления, заживают первичным натяжением. Укрепление мышечно-апоневротического слоя сетчатым протезом привело к сохранению эстетичного вида передней брюшной стенки, несмотря на объем операционной травмы.
Патогистологическое заключение: новообразование до 10 см в диаметре, соответствует десмоиду прямой мышцы живота. Края резекции без опухолевого роста.
Ведущие врачи
-
Барбинов Денис Вячеславович
Оперирующий дерматолог
ул. Маршала Захарова, 20
-
Ибрагимов Григорий Юрьевич
Оперирующий дерматолог
Дунайский пр., 47
-
Протопопов Даниил Олегович
Оперирующий дерматолог
пр. Ударников, 19, Выборгское шоссе, 17-1
-
Колесникова Екатерина Владимировна
Врач-дерматовенеролог
ул. Маршала Захарова, 20
-
Писаренко Наталия Леонидовна
Оперирующий дерматолог
пр. Ударников, 19
-
Смирнов Константин Валерьевич
Дерматовенеролог
Дунайский пр., 47
-
Зиновьева Татьяна Владимировна
Оперирующий дерматолог, дерматоонколог
Выборгское шоссе, 17-1
-
Литенев Леонид Андреевич
Дерматолог
Выборгское шоссе, 17-1
-
Мозгова Ольга Викторовна
Дерматовенеролог, трихолог
пр. Ударников, 19
Посмотреть всех
-
Саламонова Мария Владимировна
ул. Маршала Захарова, 20
-
Голубева Алёна Дмитриевна
Выборгское шоссе, 17-1
Как ушивают диастаз?
Существует несколько принципиально разных подходов к хирургической коррекции диастаза прямых мышц живота.
Чаще всего диастаз ушивается во время абдоминопластики нашими коллегами – пластическими хирургами. К сожалению, в подавляющем большинстве случаев они ограничиваются простым ушиванием белой линии (так называемая «пликация»), иногда двумя рядами швов.
Простая пликация «обычным» рассасывающимся шовным материалом грозит риском повторного появления диастаза (не говоря о грыже) в 40% случаев, по данным исследования, проведенного Van Uchelen и соавт . Конечно, такие результаты не могут нас устраивать.
Пластика местными тканями без использования сетчатого импланта вполне допустима при небольшом диастазе, шириной до 40 мм и грыже с дефектом до 10 мм. Это доказано и рекомендовано в клинических рекомендациях Европейского герниологического общества (EHS). При пластике передней брюшной стенки мы используем в своей практике нерассасывающийся шовный материал последнего поколения, «якорного» типа (V-loc PBT), который, по нашему мнению, значительно надежнее традиционно используемых вариантов, и это с лихвой компенсирует его высокую стоимость.
Хорошие результаты демонстрирует ушивание диастаза с помощью тангенциальных швов, что мы используем в некоторых случаях.
Рис 1. Тангенциальные швы при открытом ушивании диастаза прямых мышц позволяют сделать рельеф передней брюшной стенки более плоским
Диастаз более 40 мм или наличие грыжи с дефектом более 10 мм – показание к применению сетчатого импланта («сетки»).
Сетчатый имплант служит для укрепления ушитой белой линии и/или грыжевого дефекта. Бессмысленно просто закрывать ей диастаз, что я несколько раз с удивлением наблюдал у коллег – при таком варианте выпячивание белой линии после операции происходит вместе с сеткой, косметический результат этой операции – никакой.
Принципиально имплант можно разместить в различных слоях передней брюшной стенки:
Мы используем все варианты, выбирая оптимальный для каждой пациентки (пациента) в конкретной клинической ситуации. Исключая разве что вариант B – давно доказавший свою неэффективность.
Крайне редко используем расположение импланта в брюшной полости (интраабдоминально). Дело в том, что полипропилен (или полиэстер), из которого состоит сам имплант, не должен контактировать с органами брюшной полости – он вызывает массивный спаечный процесс, приводящий к спаечной кишечной непроходимости и другим угрожающим жизни осложнениям. Импланты для интраабдоминальной пластики имеют специальное противоспаечное покрытие с одной стороны, которое значительно увеличивает стоимость импланта, однако не всегда способно «защитить» органы. И если недавно это были единичные случаи, то сегодня все чаще и чаще в среде хирургов-герниологов раздаются голоса об отказе от этой методики. Я отказался от нее несколько лет назад, после того как дважды оперировал пациентов (из других клиник, и даже стран) с осложнениями. Да, это немного, но зачем подвергать пациента даже минимальному риску осложнений, которого можно избежать?
Рис. 2 Варианты размещения сетчатого импланта при пластике грыж и диастаза: A – над апоневрозом (onlay), B – вшивание в край дефекта (inlay), C – в подмышечном пространстве, D – в предбрюшинном пространстве (underlay preperitoneal), E – в брюшной полости (underlay intraperitoneal) .
Выбор оптимального слоя для расположения импланта зависит от многих факторов: от наличия и ширины дефектов апоневроза и степени диастаза – до индекса массы тела и состояния кожи пациентки. Каждый из вариантов имеет свои преимущества и недостатки, мы выбираем его совместно с пациенткой на консультации.
Типы фибром полости рта
- Плотная (твердая) фиброма. Образование состоит из грубых волокон соединительной ткани, содержащих небольшое количество ядер, плотно прилегающих друг к другу. Такая фиброма чаще всего расположена на деснах или твердом нёбе.
- Мягкая фиброма. Новообразование имеет более мягкую структуру из-за образования тонкими и рыхлыми волокнами, в структуре которых находится большое количество ядер. Локализуется такая опухоль на языке и внутри ротовой полости на щеках. В некоторых случаях могут встречаться смешанные новообразования, такие как фиброгемангиомы или фибролипомы.
- Фиброма от раздражения. Это новообразование не является опухолью и встречается довольно часто. Развивается оно в результате повреждения механическим или химическим путями. Эта фиброма располагается на слизистой оболочке ротовой полости и имеет вид папулы розового цвета с четкими границами. В процессе роста появляется плотный округлый узелок. При постоянном травмировании фибромы на ее поверхности могут появиться бугристость и изъязвление.
- Симметричные фибромы бобовидной формы и плотной консистенции обычно располагаются у трех моляров на поверхности десны верхней челюсти. Такая опухоль не является истинной фибромой, а представляет собой разрастание десны и сопровождается рубцеванием тканей.
- Дольчатая фиброма. Это новообразование отличает бугристая поверхность, возникающая в результате реактивной гиперплазии тканей десны при ее регулярном травмировании, например, снимаемым протезом.
- Фиброзный эпулис. Данное новообразование плотной консистенции располагается на деснах и имеет замедленный рост.